

利用CO2合成杂环化合物是一个充满活力的研究领域,它可以将廉价的碳试剂固定为具有合成价值的中间体和产物。在药物开发中,环氨基甲酸酯是一类极具吸引力的中间体,在构建具有生物活性的骨架中有重要作用。此外,化学家最近还发现了五元环氨基甲酸酯作为单体用于开环聚合合成聚氨酯的潜力。苯并噁嗪-2-酮类衍生物是一类特殊的环氨基甲酸酯,这类骨架经常在Droxicam等药物分子中发现,在药物化学领域具有重要意义。对于苯并噁嗪-2-酮直接催化方法的设计和开发仍然是一个挑战。除了1,3-氨基醇、1,3-二卤烷和相关前体以及1-氨基-3-氯丙烷-2-醇衍生物的化学计量转化外,在50 bar下使用牺牲丁腈作为水清除剂的方式利用CeO2促进这些化合物的形成是可行的。另外,以NIS为基础,在CO2存在下活化烯丙基胺可以高对映选择性地合成六元环氨基甲酸酯。值得注意的是,Yamada课题组报导了在Ag-催化下通过2-烷基苯胺和CO2合成苯并噁嗪-2-酮。作者此前的工作展示了1,2-烷基二醇的用途:在与CO2结合后,首先形成α-烷基二醇碳酸酯,然后在分子内发生醇诱导的异构化,进而转化为酮环碳酸酯。受到这种串联过程的启发,作者提出一种合成该类产物的新概念。该方法首先应生成五元环碳酸酯,然后由N-亲核试剂进攻重排形成六元环氨基甲酸酯。该方法显著扩大了苯并噁嗪-2-酮的范围和合成用途。另外,从廉价易得的碳试剂中获得更广泛的基于CO2的杂环化合物将进一步促进新的生物活性化合物的设计与合成。
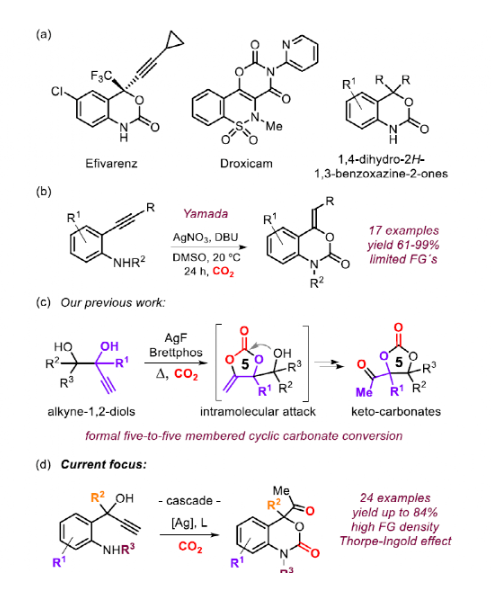
图1. 研究背景(图片来源:Angew. Chem. Int. Ed.)基于此前炔烃-1,2-二醇成功转化为环状碳酸盐,作者认为,通过用胺取代其中一个羟基,在加入CO2时有利于半氨基甲酸酯的生成,作者猜测这类活泼中间体很容易与炔反应直接形成五元或六元环氨基甲酸酯。但起初对于反应条件的筛选没有得到环氨基甲酸酯,相反,优先以80%的收率生成吡咯A。这一结果表明,胺对CO2的活化不能与热力学上有利的五元环形成相竞争。各种反应条件和催化剂的筛选并没有引发六元环氨基甲酸酯产物的形成,但意外地发现2,2'-双吲哚林-3,3'-二酮D作为反应的主要产物,最高产率为30%。最后,作者对底物进行改动(E),将二级醇改为三级醇,提高了在-OH基团活化CO2时通过Thorpe-Ingold效应关环的概率。
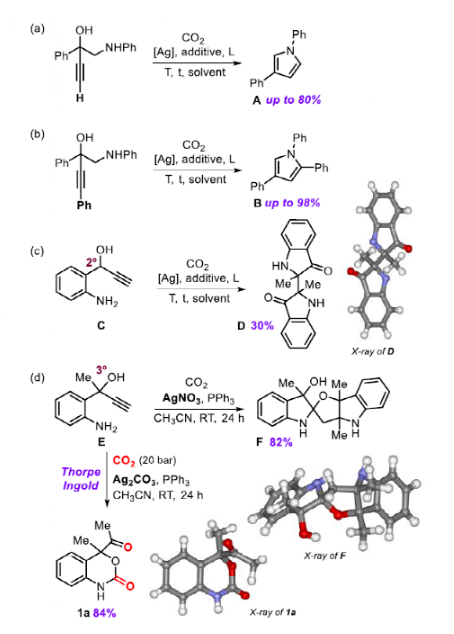
图2. 条件筛选一(图片来源:Angew. Chem. Int. Ed.)
在一系列尝试后,作者确定反应的最佳条件为Ag2CO3(1.5 mol%)、PPh3(6 mol%)、CO2(20 bar)且乙腈为溶剂时在室温下反应24 h可以84%产率得到目标产物1a。
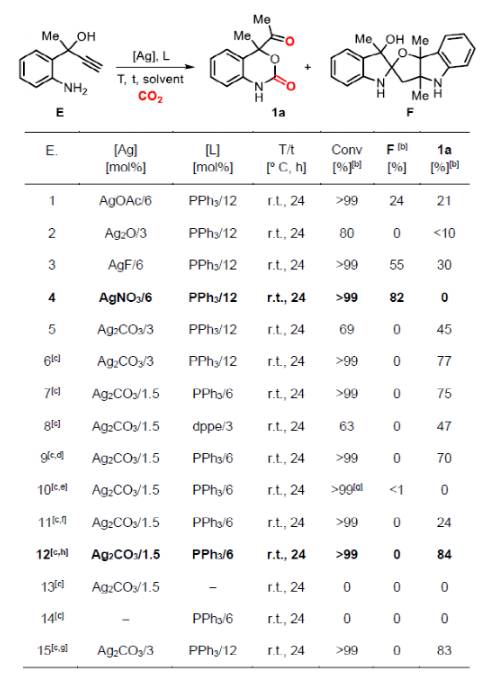
图3. 条件筛选二(图片来源:Angew. Chem. Int. Ed.)
随后,作者在最优条件下进行底物拓展。首先,作者对苯环取代基的适用范围进行探索。不同种类和位置的卤素取代的苯并噁嗪-2-酮(1b-1d, 1f和1g)收率最高达65%,且延长反应时间和适当升高反应温度利于某些反应的进行。苯基取代底物1e(68%)和萘环底物1h(63%)同样可以顺利反应。邻位取代的芳环(1i和1j)也是可行的,底物转化率高和收率良好(51-76%)。
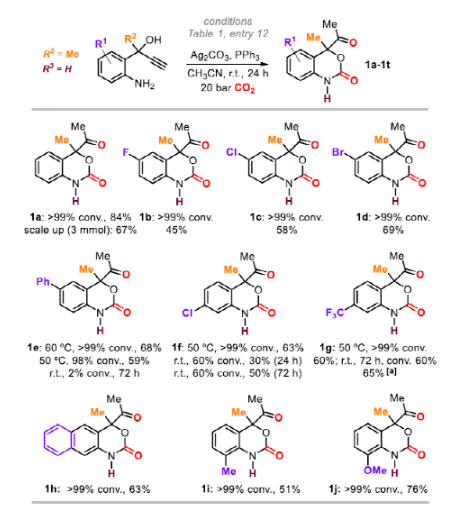
图4. 底物拓展一(图片来源:Angew. Chem. Int. Ed.)
接下来是对R2范围的探究。芳基取代产物2a产率为40%,烷基取代产物(2b-2h)的产率为34-56%。R2的空间位阻对反应结果有着关键作用,这可能解释了为什么2a(40%)和2h(32%)的产率相对较低。末端烯烃(2e)和环庚基(2h)取代的底物同样适用,产率分别为52%和44%。当R2中含有杂环时为观察到产物,这可以解释为,杂原子与Ag配位阻止了关键的炔活化步骤,从而导致催化剂失活。
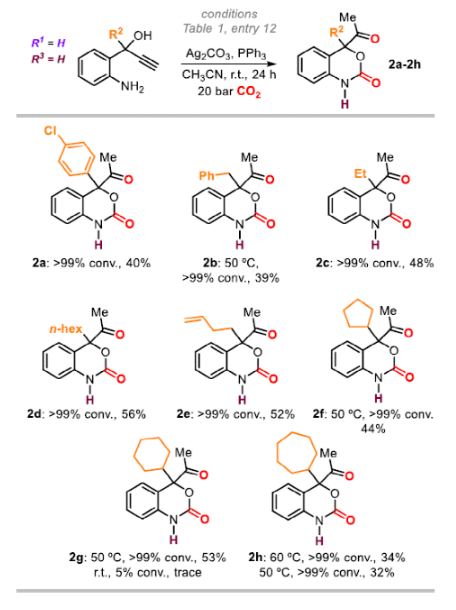
图5. 底物拓展二(图片来源:Angew. Chem. Int. Ed.)
最后,作者通过引入酰基取代基来改变底物中的N-基团。N-乙酰基的产物3a的产率为53%,更复杂的酰基(3b和3c)的产率为53%和56%。较大位阻N-酰基需要使用更高的反应温度/压力和更长的反应时间,如3d (56%,72 h, 50ºC),3e (84%,50 bar, 75ºC)和3f(62%,75ºC)。
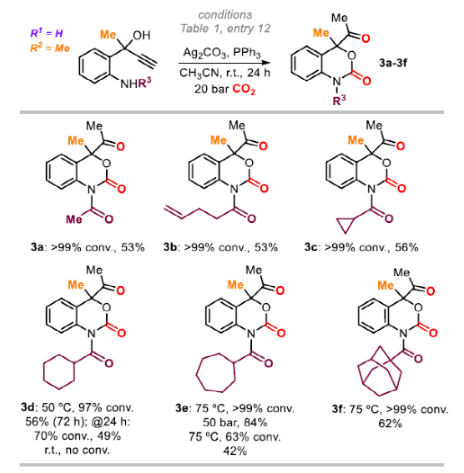
图6. 底物拓展三(图片来源:Angew. Chem. Int. Ed.)
结合前人的工作和实验结果,作者基于底物G对反应机理进行了探究。作者设想的反应机理遵循一个串联过程,首先是五元环碳酸酯的生成,然后通过N-亲核试剂对Ag活化的环碳酸酯进攻,最终生成六元环氨基甲酸酯。前人的工作显示相对缺电子的PPh3可以最大程度地提高Ag+对炔的活化电位。而N取代基的大小对于第二步的动力学非常重要。为验证这一假设,作者进行了一系列对照实验。当反应条件为室温时,24 h后未观察到G反应。当温度提高到50 ℃时,产物H产率为79%。1H-NMR和IR的结果显示反应生成了α-烷基碳酸酯,这可以通过X-射线晶体学分析得到证实。作者设想的六元环碳酸酯3f是在75 ºC下生成的,因此作者想确定H是否可以通过Ag催化剂转化为3f。在Ag2CO3/PPh3存在的情况下,在82 ºC处理H会缓慢地转化为3f(收率35%)。在没有催化剂的情况下重复实验结果相似。这表明Ag催化剂没有参与第二步。另外,虽然第二步可以通过增加N-取代基的位阻来减慢,但第一步也容易受到位阻的影响。当1a中的-Me被-tBu (I)取代时,即使将温度提高到60 ºC,也没有观察到任何反应。这与作者串联过程的机理假设很吻合,串联过程提供了独特的扩环产物,从而产生新的药物分子。
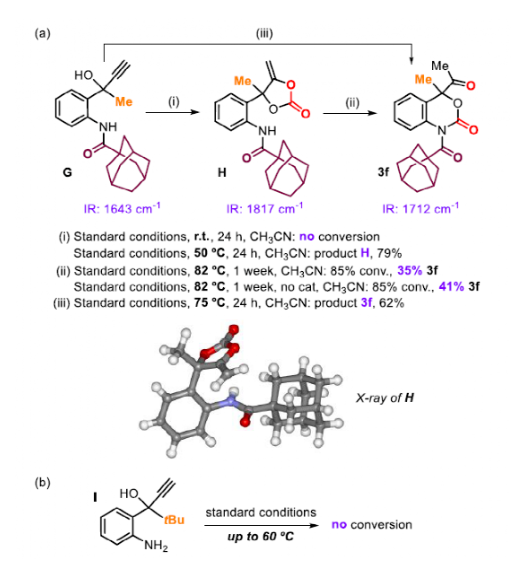
图7. 机理实验(图片来源:Angew. Chem. Int. Ed.)
总结
Arjan W. Kleij课题组利用廉价的CO2为碳源提出了一个全新概念的串联合成路线,以合成1,4-二氢- 2h -1,3-苯并噁嗪-2-酮,具有良好的适用范围。该方法利用独特的Ag活化方式,经历五元碳酸酯中间体后与N-亲核试剂作用得到目标产物六元氨基甲酸酯。这一新概念可用于药物相关化合物库的快速扩展,从而为药物发现提供新的可能。
文献详情:
Xuetong Li, Jordi Benet-Buchholz, Eduardo C. Escudero-Adán, Arjan W. Kleij*. Silver-Mediated Cascade Synthesis of Functionalized 1,4-dihydro-2H-Benzo-1,3-Oxazin-2-Ones from Carbon Dioxide. Angew. Chem. Int. Ed. 2023
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn