- 首页
- 资讯
JACS:铜催化N-烷基化不对称合成α-氨基硼酸衍生物
来源:化学加原创 2023-02-13
导读:制药工业中,光学活性α-氨基硼酸衍生物作为α-氨基酸衍生物的生物电子等排物的应用越发重要,而其催化不对称合成方法是一项重要挑战。近日,美国国家科学院院士、美国艺术与科学院院士、加州理工学院Gregory C. Fu课题组报道了一种铜催化氨基甲酸酯和外消旋α-氯代硼酸酯的N-烷基化反应,实现了α-氨基硼酸衍生物的对映选择性合成。同时,作者还对反应的机理进行了研究。文章链接DOI:10.1021/jacs.3c00038

(图片来源:J. Am. Chem. Soc.)
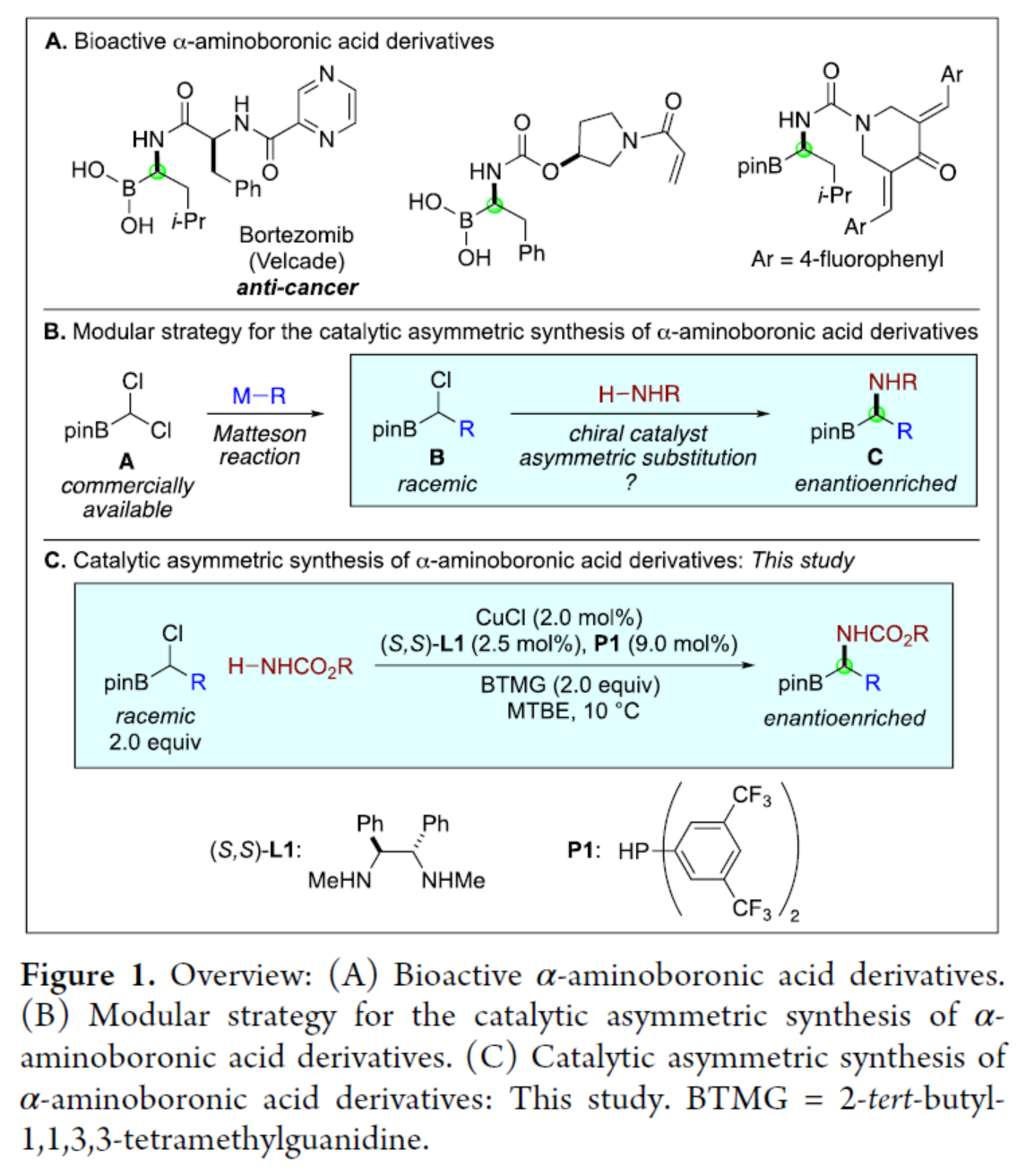
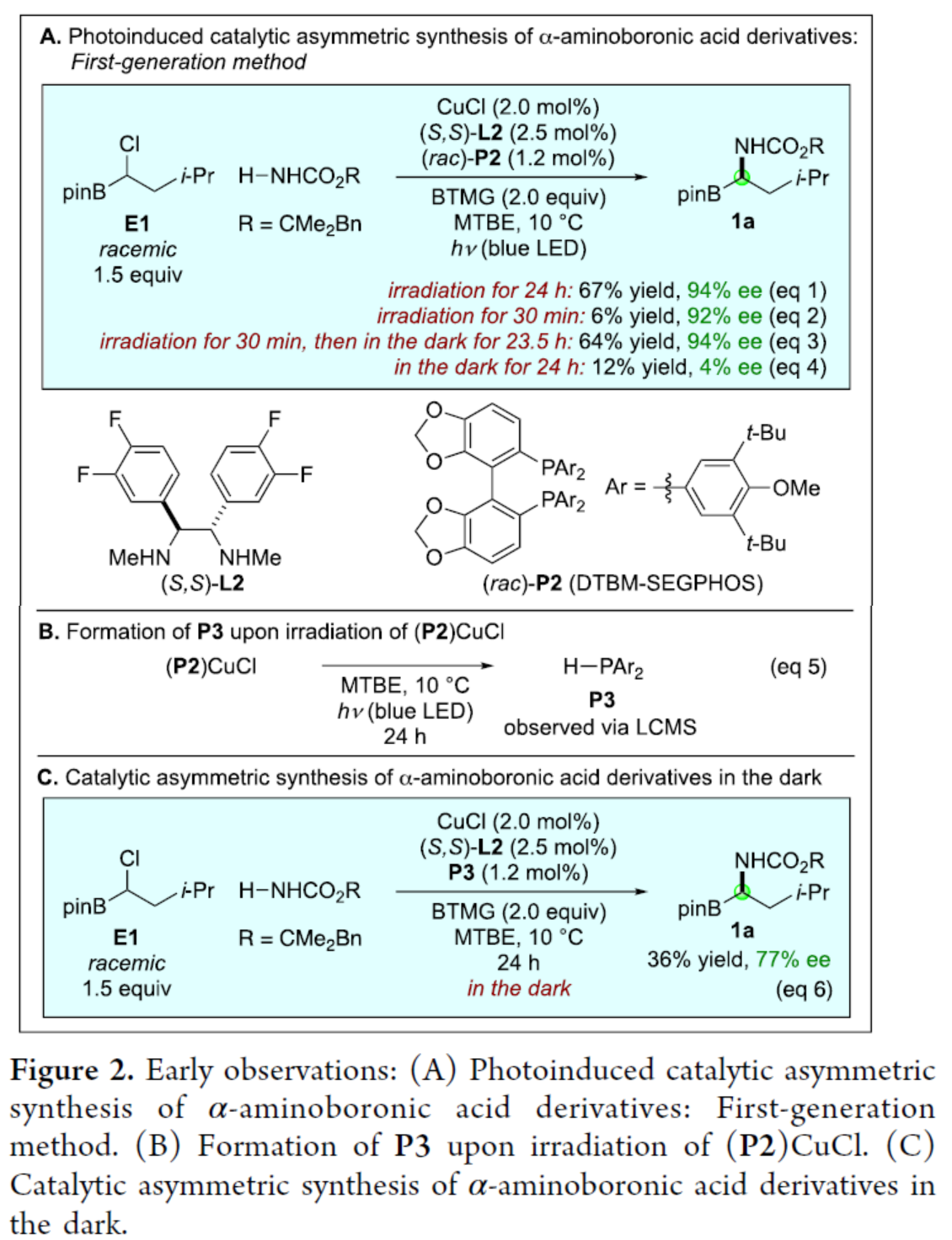
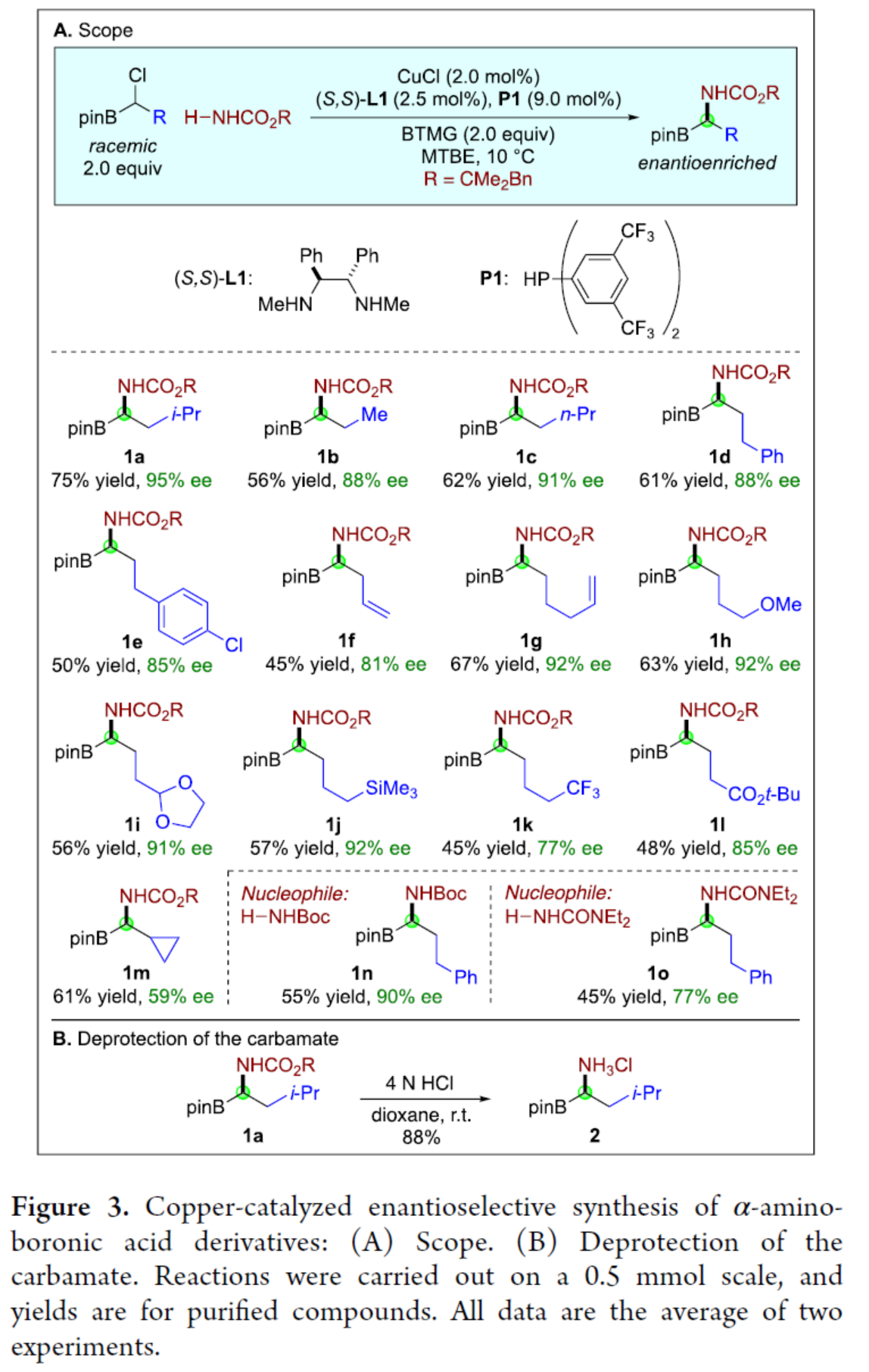
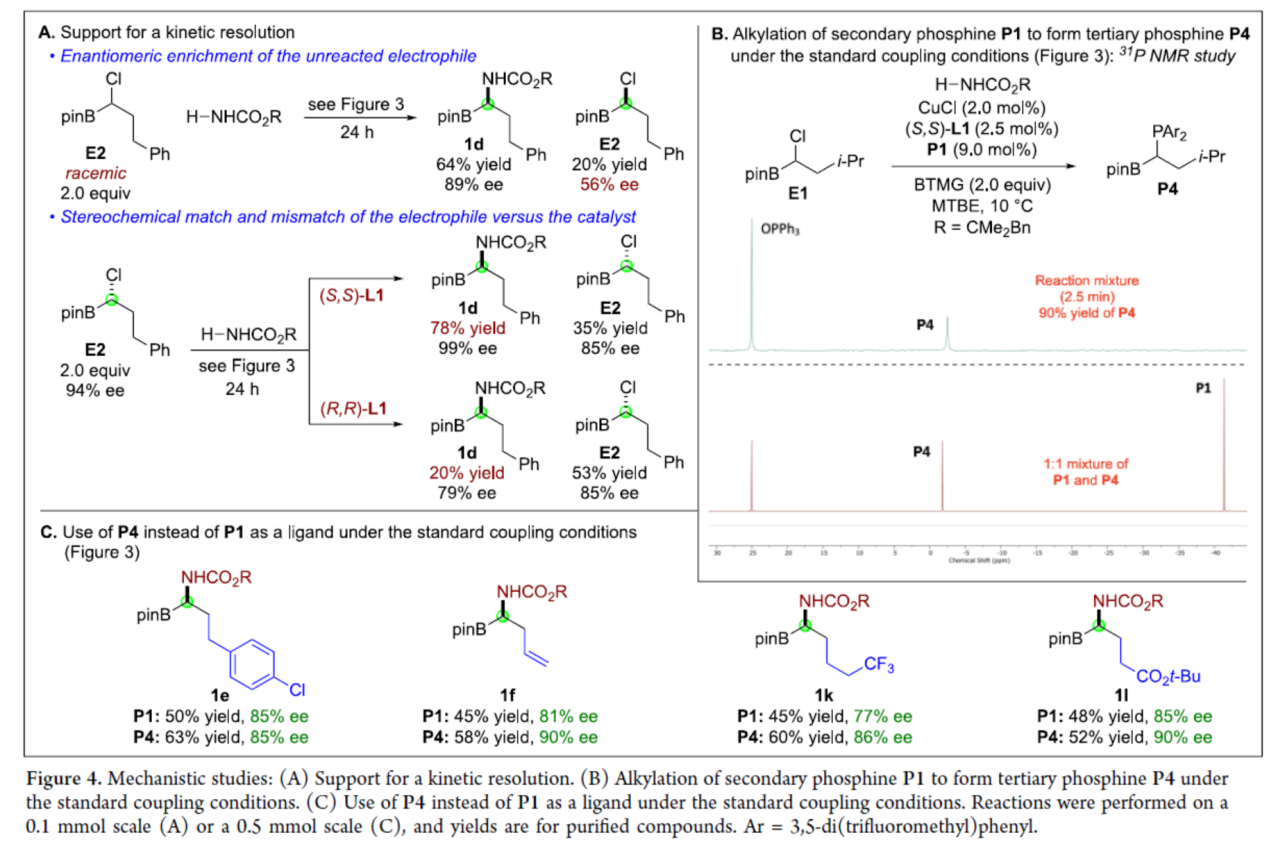
具有生物活性的α-氨基硼酸衍生物在抗菌、抗癌、抗病毒等方面具有重要作用,因此此类化合物的对映选择性合成备受化学家们的关注(Figure 1A)。早期控制α-手性中心的方法主要依赖于非对映选择性过程,例如手性助剂,其中化学家们也开发了手性催化剂控制手性中心的方法,如烯基硼酸酯的氢胺化、醛亚胺和酮亚胺的硼化、烯酰胺的加氢硼化、末端炔烃的串联硼氢化-氢胺化以及硼基取代亚胺的氢化反应。此外,化学家们还开发了一种催化不对称合成α-氨基硼酸衍生物的补充方法,其中以市售的linchpin A为底物(Figure 1B)。首先,通过碳亲核试剂的取代反应生成了外消旋B,然后氮亲核试剂进行不对称取代反应,从而生成了对映体富集的目标产物C(此类反应存在如下的挑战:立体化学的控制、HCl消除、NH2R的过度烷基化等)。虽然经典的取代途径(如SN1和SN2)通常不适合此类型的不对称取代反应,但最近化学家们发现,手性催化剂可实现相关氮亲核试剂和外消旋亲电试剂之间的不对称取代反应。近日,Gregory C. Fu课题组报道了一种手性铜催化氨基甲酸酯和外消旋α-氯代硼酸酯的N-烷基化反应,实现了α-氨基硼酸衍生物的对映选择性合成(Figure 1C)。基于前期的研究成果(Nature 2021, 596, 250.),Fu课题组发现,E1与氨基甲酸酯在光照射条件下反应24 h后,可以67%的收率和94%ee得到所需的C-N偶联产物1a(Figure 2,eq 1)。在对照实验中,E1与氨基甲酸酯在光照射条件下反应30 min 后,可以6%的收率和92%ee得到产物1a(eq 2),随后在无光的条件下继续反应23.5 h,反应可继续进行,并以64%的收率和94%ee得到产物1a(eq 3)。当在无光的条件下反应时,仅获得少量的产物1a(eq 4),表明了光对于启动不对称催化是至关重要的,但不影响不对称催化的反应过程。其次,在优化的条件下,光催化剂(P2)CuCl在蓝色LED照射下,可生成二级膦(P3)(eq 5)。此外,使用配体P3代替P2,在无光的条件下反应时,可以36%的收率和77%ee得到产物1a(eq 6)。通过对反应条件的进一步优化后发现,P1/CuCl/手性二胺L1的结合,作为最佳催化体系。在获得上述最佳反应条件后,作者对底物范围进行了扩展(Figure 3)。首先,当底物中的R为一系列烷基取代时,均可顺利进行反应,获得相应的产物1a-1l,收率为45-75%,ee为77-95%。当底物中的R为环丙基取代时,可以61%的收率得到产物1m,ee为59%。值得注意的是,一系列活性的基团,如卤素、烯基、烷氧羰基等,均与体系兼容。其次,H2NBoc也是合适的亲核试剂,可以55%的收率得到产物1n,ee为90%。当使用尿素作为亲核试剂时,可以45%的收率得到产物1o,ee为77%。此外,克级规模实验,同样能够以70%的收率和96%ee获得产物1a。在酸性条件下,氨基甲酸酯1a可以很容易地转化为铵盐2,收率为88%,且对映选择性不受影响(Figure 3B)。紧接着,作者对反应的机理进行了研究(Figure 4)。首先,外消旋E2与氨基甲酸酯反应后,可以64%的收率和98%ee得到产物1d,并以20%的收率和56%ee回收了未反应的亲电试剂E2,表明了手性催化剂优先与外消旋底物中的一种对映体反应,从而实现了动力学拆分。同时,当使用手性的亲电试剂E2分别与两种不同的催化剂对映体反应时,由于匹配/不匹配的立体化学,反应可以不同的速率生成相应的产物。在这两种情况下,亲电试剂的取代主要在碳位发生立体化学反转(Figure 4A)。其次,通过亲电试剂E1的铜催化对映选择性取代的31P NMR谱监测发现,亲电试剂将可将二级膦P1烷基化为三级膦P4。由于这种快速的P-烷基化,作者认为,在亲电试剂E1的对映选择性取代过程中,P4充当铜的辅助配体。此外,在标准条件下,使用三级膦P4代替二级膦P1时,可以相似的收率和对映选择性得到所需的偶联产物(Figure 4C)。美国国家科学院院士、美国艺术与科学院院士、加州理工学院Gregory C. Fu课题组开发了一种新型的模块化方法,通过手性铜催化氨基甲酸酯和外消旋α-氯代硼酸酯的N-烷基化反应,实现了α-氨基硼酸衍生物的对映选择性合成。同时,该策略采用了市售的催化剂组合(CuCl、手性二胺L1和二级膦P1),并具有良好的官能团兼容性。机理研究表明,手性铜催化剂实现了外消旋亲电试剂的动力学拆分,并且在反应条件下,二级膦P1可被α-氯代硼酸亲电试剂烷基化,生成的三级膦可能在对映选择性C-N键形成过程中充当铜的配体。
文献详情:
Giuseppe Zuccarello, Suzanne M. Batiste, Hyungdo Cho, Gregory C. Fu*. Enantioselective Synthesis of α‑Aminoboronic Acid Derivatives via Copper-Catalyzed N‑Alkylation. J. Am. Chem. Soc. 2023, https://doi.org/10.1021/jacs.3c00038
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn