- 首页
- 资讯
JACS:芳烃的形式脱氢合成芳炔
来源:化学加原创 2023-02-13
导读:近日,美国波特兰州立大学David R. Stuart课题组报道了一种简单芳烃的两步形式脱氢策略,可在相对于传统反应性基团(如卤化物)较远的位置生成芳炔衍生物。其中,该方法是通过区域选择性地引入和去除“鎓”离去基团实现的。同时,简单芳烃(20例)和arynophiles(8例)均与体系兼容。此外,通过与目前芳炔前体的合成策略相比,该形式脱氢策略在生成芳炔方面更具出色的官能团兼容性和效率。与其它方法不同,芳炔中间体还为区域选择性C-H胺化提供了机会。文章链接DOI:10.1021/jacs.2c13007
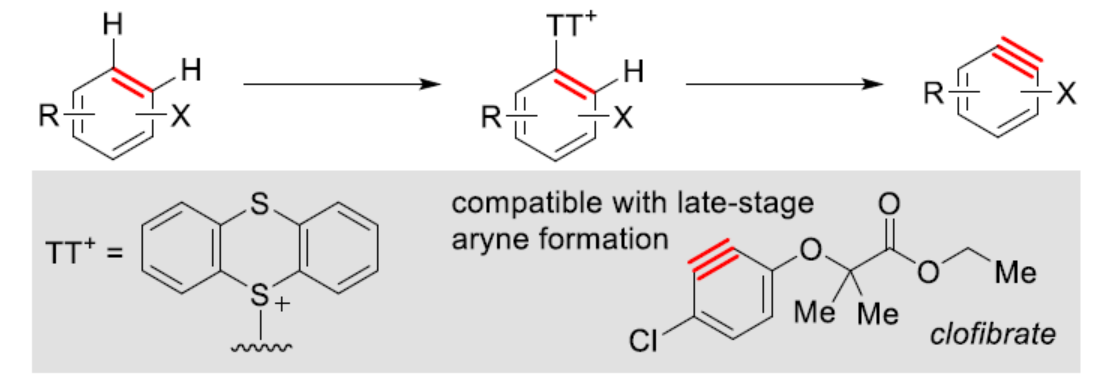
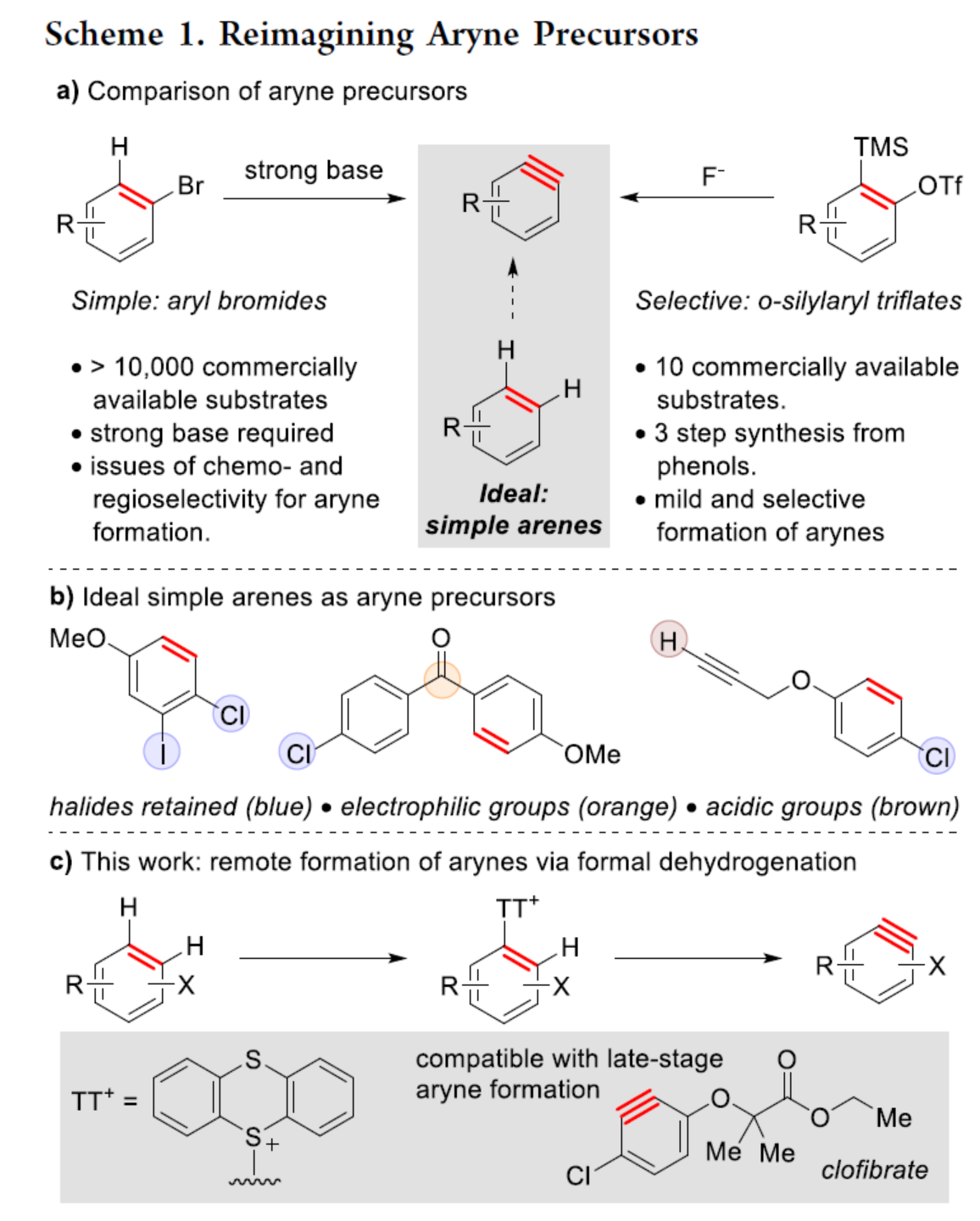
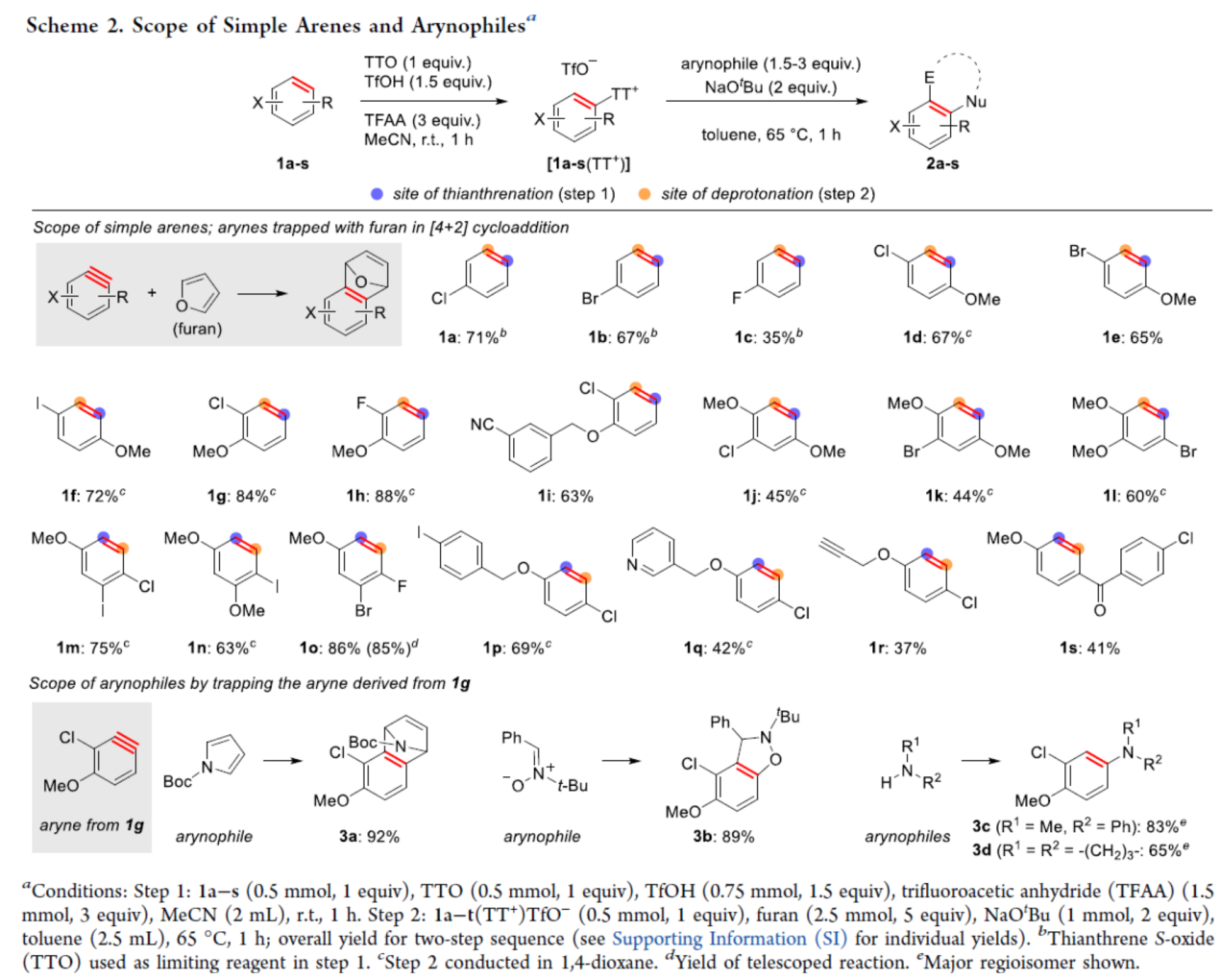
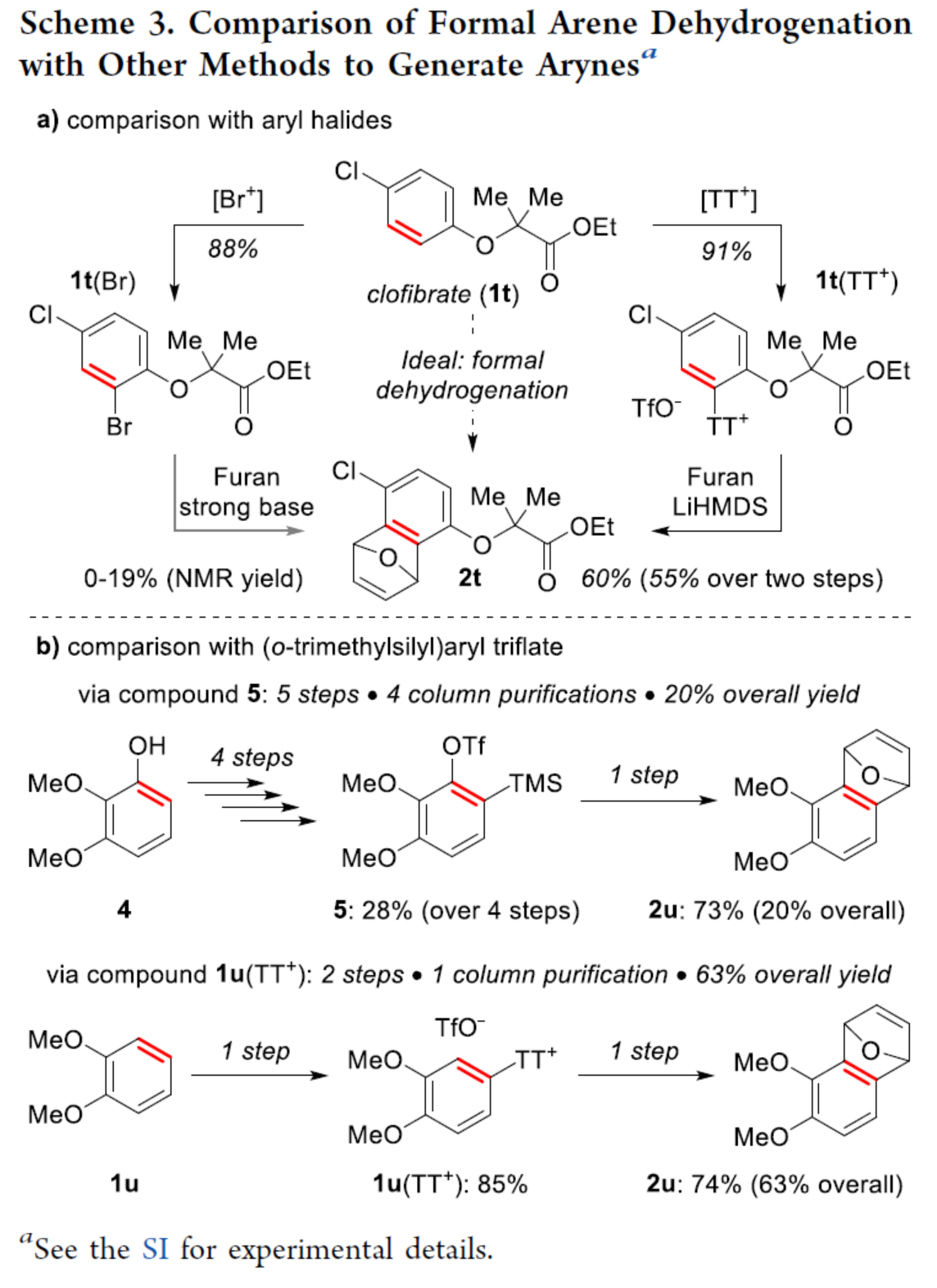
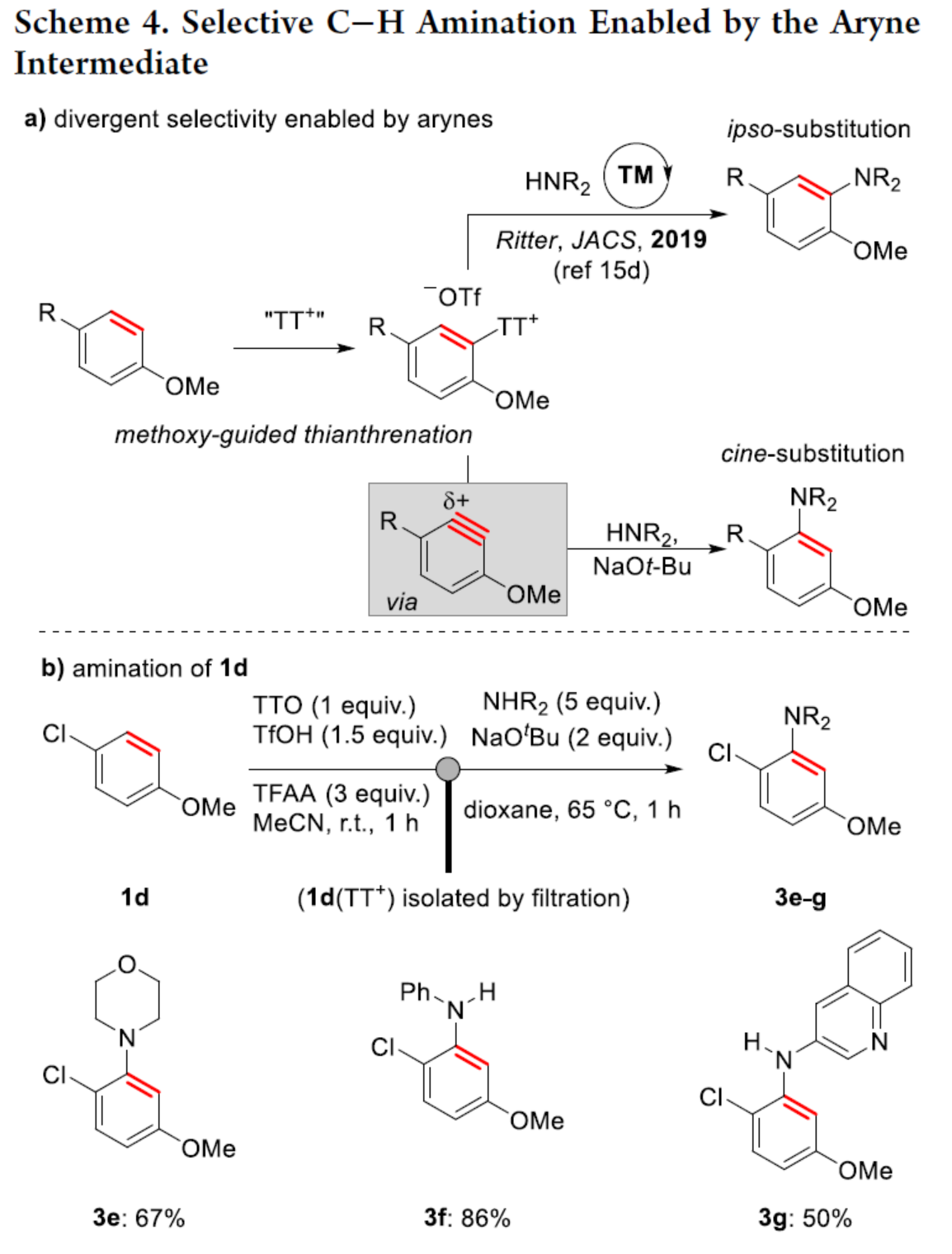
自从一个多世纪前,芳炔化合物被发现以来,由于其在合成方面的多功能性,芳炔化合物的合成一直备受关注。这些高反应性中间体通常不易分离和储存,因此需要合成前体来充分利用其反应性。芳炔化学的许多显著进展涉及开发新的前体或开发合成芳炔的新方法。目前,化学家们发现了两种简单性的芳炔前体(Scheme 1a)。其中,芳基卤化物是最简单的芳炔前体,但此类反应常需强碱来进行芳环的去质子化并消除卤化物离去基团,导致数千种商用芳基卤化物的优势被削弱(Scheme 1a,left)。钠和锂酰胺、烷基锂和叔丁醇钾以及18-冠-6是这种方法的已知碱,但它们与酸性和亲电官能团不相容,导致了底物范围有限。同时,在多卤代芳烃中,也存在去质子化和卤化物离去的低选择性问题。为了解决芳基卤化物的区域选择性和化学选择性问题,化学家们发现了一种(邻三甲基硅基)芳基三氟甲磺酸酯试剂(Scheme 1a,right)。然而,此类试剂不易直接购买,并且它们的合成通常需要从苯酚经三至四步反应。同时,(邻三甲基硅基)芳基三氟甲磺酸酯试剂需要使用烷基锂试剂来引入三甲基硅基,从而限制了这些芳炔前体中的酸性和亲电性的官能团。因此,简单芳烃的直接形式脱氢仍是合成芳炔的理想合成前体。理想情况下,简单芳烃的脱氢将以选择性的方式进行,其中合成有用的卤化物被完全保留,并且亲电和酸性官能团也是相容的(Scheme 1b)。因此,各种简单的芳烃砌块可以作为芳炔的前体,从而扩大这些中间体的合成潜力。近日,美国波特兰州立大学David R. Stuart课题组报道了一种简单芳烃的两步形式脱氢策略,合成了一系列芳炔衍生物,具有出色的官能团兼容性与区域选择性(Scheme 1c)。其中,位点选择性芳炔的形成是通过区域选择性地引入和去除“鎓”离去基团(噻蒽鎓,TT+)来实现的。首先,作者以氯苯1a与呋喃作为模型底物,进行了相关三组分偶联反应条件的筛选(Table 1)。当氯苯1a在TTO/TfOH/TFAA条件下室温反应1 h,可生成含有TT+离去基团的中间体1a(TT+)。随后,当以NaOt-Bu(2 eq.)作为碱,1a(TT+)可与呋喃在甲苯溶剂中65 oC反应1 h,可以81%的收率得环加成产物2a。在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 2)。首先,一系列简单的芳烃,均可顺利进行反应,获得相应的产物2a-2s,收率为35-88%。值得注意的是,该反应具有出色的官能团兼容性,如炔基、卤素等均与体系兼容。其次,该策略还可以环加成(吡咯和硝酮)和亲核加成(苯胺和氮杂烷)的方式进行,获得相应的产物3a-3d,收率为65-92%。为了进一步证明反应的兼容性以及效率,作者对该形式芳烃脱氢策略与其它方法生成芳炔的策略进行了对比(Scheme 3)。首先,以氯贝特(clofibrate,1t)作为底物,分别生成了中间体1t(Br)(收率为88%)和1t(TT+)(收率为91%)。其中,1t(Br)的溴化时间长达72 h,且需柱色谱进行分离纯化。然而,1t(Br)在强碱性条件下未能有效的与呋喃进行反应。相比之下,1t(TT+)可在LiHMDS条件下顺利进行环加成反应,可以60%的收率得到产物2t,两步总收率为55%(Scheme 3a)。其次,以市售苯酚4为底物,通过四步反应以及三次柱纯化过程,可分别引入-OTf与-TMS,并以28%的总收率得到中间体5。5可与呋喃进行环加成反应,可以73%的收率得到产物2u。因此,以4为底物合成产物2u共需五步反应,四次柱纯化过程,总收率为20%(Scheme 3b)。相比之下,以1u作为底物,可以85%的收率得到芳炔前体1u(TT+),仅需通过简单的过滤分离即可。在NaOt-Bu条件下,1u(TT+)可与呋喃进行环加成反应,可以74%的收率得到产物2u。因此,通过该策略仅需两步反应(先生成1u(TT+),再与呋喃进行环加成反应)以及一次色谱纯化,即可在数小时内从简单芳烃1u得到产物2u,总收率为63%。此外,作者还对芳炔中间体选择性C-H胺化反应进行了研究(Scheme 4)。首先,利用芳炔中间体与NHR2反应,可获得cine-取代的胺化产物,并作为Ritter课题组(J. Am. Chem. Soc. 2019, 141, 13346.)合成ipso-取代的胺化产物的补充(Scheme 4a)。其次,通过1d生成的芳炔前体1d(TT+),可分别与吗啉、苯胺和3-氨基喹啉进行胺化反应,获得相应的产物3e-3g,收率为50-86%(Scheme 4b)。
美国波特兰州立大学David R. Stuart课题组报道了一种简单芳烃的形式脱氢生成芳炔前体的策略。该策略使用噻蒽鎓(thianthrenium)基团作为双电子氧化剂,从而使反应能够在相对温和的条件下进行。与目前已知的方法相比,该策略具有出色的官能团耐受性,并提供了一种高效和选择性的合成芳炔的方法。此外,芳炔中间体还可参与多种不同的转化,进一步证明了反应的实用性。
文献详情:
Riley A. Roberts, Bryan E. Metze, Aleksandra Nilova, David R. Stuart*. Synthesis of Arynes via Formal Dehydrogenation of Arenes. J. Am. Chem. Soc. 2023, https://doi.org/10.1021/jacs.2c13007
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn