- 首页
- 资讯
JACS:可见光诱导膦催化烯丙基羧酸酯的1,3-碳溴化反应
来源:化学加原创 2023-12-07
导读:美国纽约州立大学Ming-Yu Ngai与埃默里大学Djamaladdin G. Musaev课题组首次报道了一种可见光诱导膦催化烯丙基羧酸酯的1,3-碳溴化反应,合成了一系列具有价值的取代的异丙基羧酸酯衍生物(sIPC)。同时,该策略具有广泛的官能团耐受性、适用于复杂分子的后期修饰和克级规模合成,并扩展了烯丙基羧酸酯和膦催化的反应种类(reaction profiles)。初步的实验和计算研究表明,非链式自由基(non-chain-radical)机理涉及电子供体-受体配合物的形成、1,2-自由基迁移(RaM)和溴原子转移的过程。文章链接DOI:10.1021/jacs.2c11867
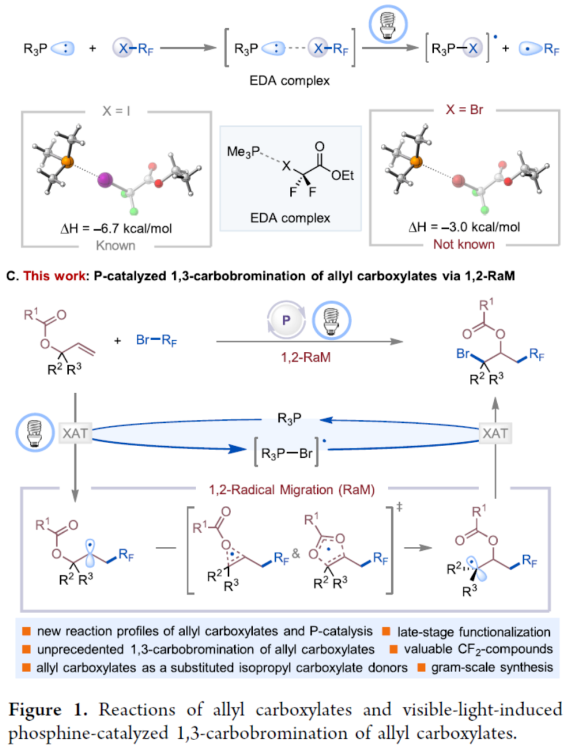
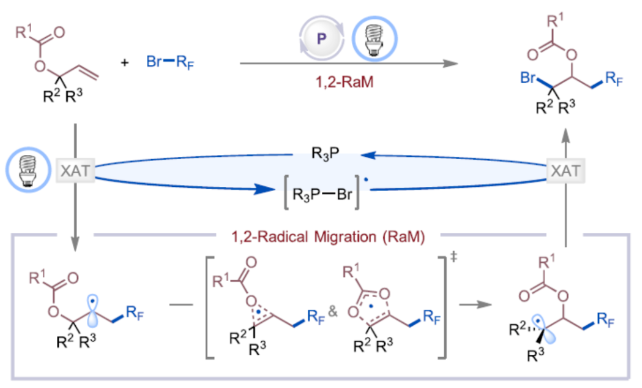 烯丙基羧酸酯是一种具有多种用途的合成中间体,可用于多种反应。例如,它们可以参与过渡金属(TM)催化的双电子氧化还原反应(Figure 1A),涉及通过TM-π-烯丙基中间体与亲核试剂或亲电试剂反应的过程,合成了一系列烯丙基化有机化合物。烯丙基羧酸酯中的烯基也可与自由基配合物进行单电子氧化还原反应生成可以参与交叉偶联反应的烷基自由基中间体,合成了相应的1,2-双官能团化产物。尽管已取得了这些进展,但涉及1,2-自由基迁移(RaM)的烯丙基羧酸酯的催化自由基1,3-双官能团化仍然难以捉摸。受Surzur-Tanner重排的启发,其中β-(酰氧基)烷基自由基通过酰氧基转移进行1,2-RaM,形成了更稳定的自由基中间体,作者设想,是否可通过1,2-RaM机理实现烯丙基羧酸酯的催化自由基1,3-双官能团化反应。下载化学加APP到你手机,更加方便,更多收获。膦基催化已成为有机合成中一种很有前途的策略,可用于碳-碳和碳-杂原子键的形成。在这一领域,绝大多数反应,如亲核膦催化和膦氧化物催化,都利用膦化合物的双电子氧化还原反应性产生离子中间体。相比之下,膦催化生成自由基配合物的单电子途径却较少有相关的研究。这种反应的一种方法涉及卤素原子转移(XAT)反应形成电子供体-受体(EDA)配合物。这些EDA配合物在光激发下可生成烷基自由基和卤化膦自由基(Figure 1B)。2019年,Czekelius课题组首次报道了一种可见光诱导膦催化烯烃的1,2-二官能团化反应。然而,通过相同的活化模式活化相应的溴二氟乙酸酯衍生物仍然难以捉摸。美国纽约州立大学Ming-Yu Ngai与埃默里大学Djamaladdin G. Musaev课题组首次报道了一种可见光诱导膦催化烯丙基羧酸酯的1,3-碳溴化反应,合成了一系列具有价值的取代的异丙基羧酸酯衍生物(Figure 1C)。
烯丙基羧酸酯是一种具有多种用途的合成中间体,可用于多种反应。例如,它们可以参与过渡金属(TM)催化的双电子氧化还原反应(Figure 1A),涉及通过TM-π-烯丙基中间体与亲核试剂或亲电试剂反应的过程,合成了一系列烯丙基化有机化合物。烯丙基羧酸酯中的烯基也可与自由基配合物进行单电子氧化还原反应生成可以参与交叉偶联反应的烷基自由基中间体,合成了相应的1,2-双官能团化产物。尽管已取得了这些进展,但涉及1,2-自由基迁移(RaM)的烯丙基羧酸酯的催化自由基1,3-双官能团化仍然难以捉摸。受Surzur-Tanner重排的启发,其中β-(酰氧基)烷基自由基通过酰氧基转移进行1,2-RaM,形成了更稳定的自由基中间体,作者设想,是否可通过1,2-RaM机理实现烯丙基羧酸酯的催化自由基1,3-双官能团化反应。下载化学加APP到你手机,更加方便,更多收获。膦基催化已成为有机合成中一种很有前途的策略,可用于碳-碳和碳-杂原子键的形成。在这一领域,绝大多数反应,如亲核膦催化和膦氧化物催化,都利用膦化合物的双电子氧化还原反应性产生离子中间体。相比之下,膦催化生成自由基配合物的单电子途径却较少有相关的研究。这种反应的一种方法涉及卤素原子转移(XAT)反应形成电子供体-受体(EDA)配合物。这些EDA配合物在光激发下可生成烷基自由基和卤化膦自由基(Figure 1B)。2019年,Czekelius课题组首次报道了一种可见光诱导膦催化烯烃的1,2-二官能团化反应。然而,通过相同的活化模式活化相应的溴二氟乙酸酯衍生物仍然难以捉摸。美国纽约州立大学Ming-Yu Ngai与埃默里大学Djamaladdin G. Musaev课题组首次报道了一种可见光诱导膦催化烯丙基羧酸酯的1,3-碳溴化反应,合成了一系列具有价值的取代的异丙基羧酸酯衍生物(Figure 1C)。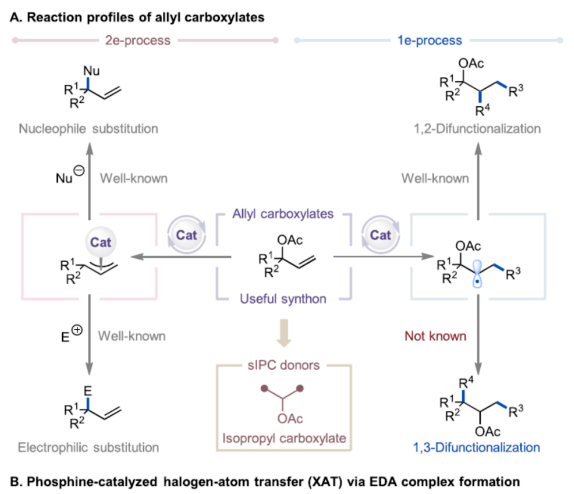
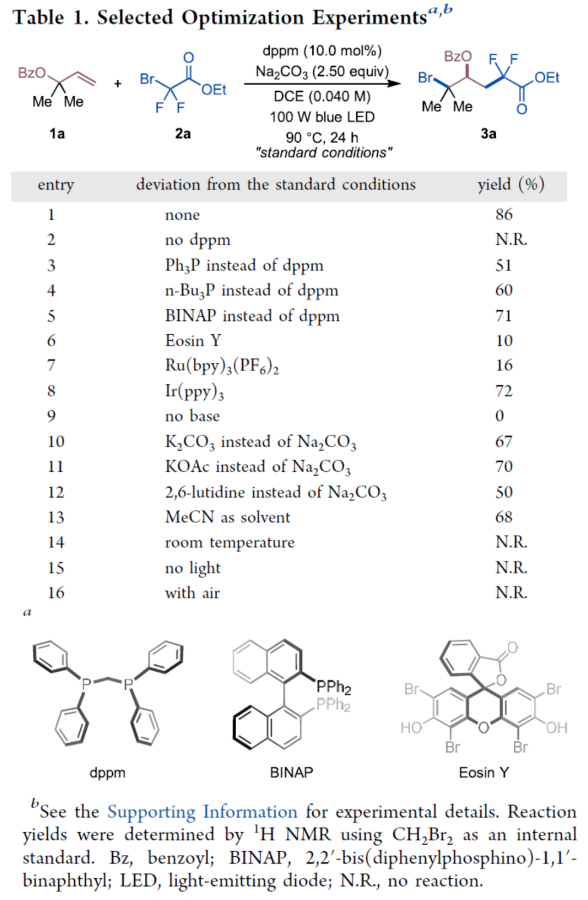
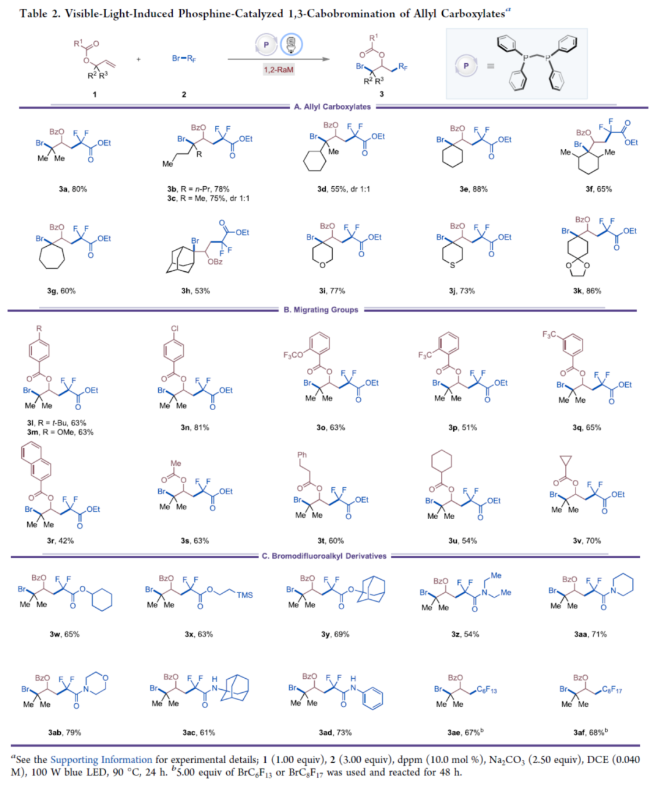
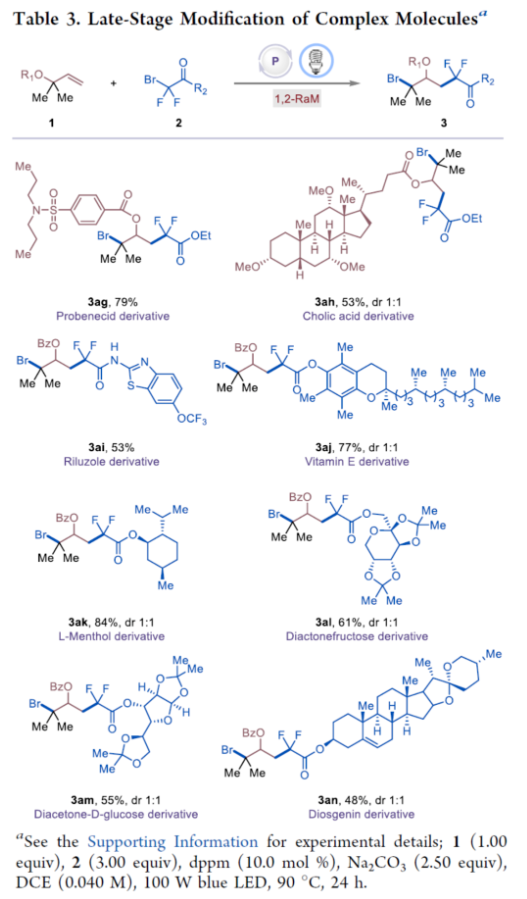
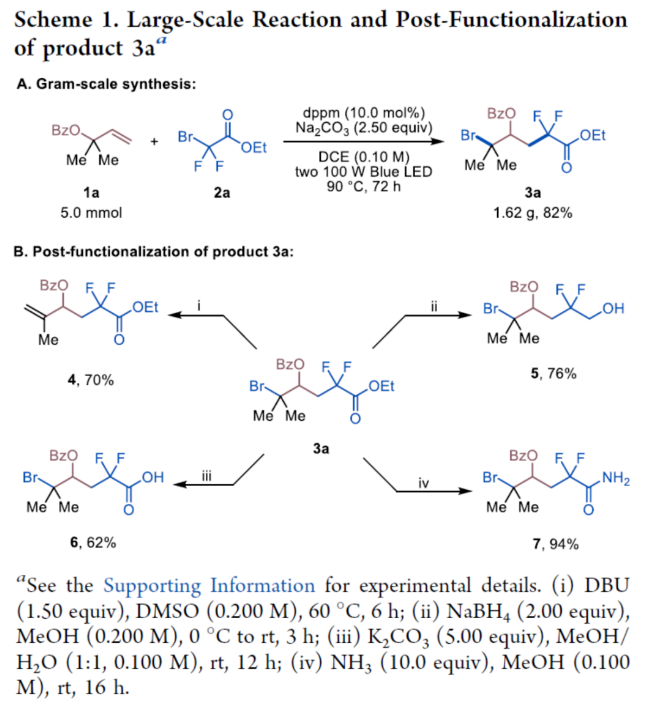
首先,作者以苯甲酸烯丙酯1a与二氟溴乙酸乙酯2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以双二苯基膦甲烷(dppm,10.0 mol%)作为催化剂,Na2CO3(2.50 equiv)作为碱,100 W蓝色LED作为光源,在DCE溶剂中90 oC反应24 h,可以86%的收率得到产物3a。在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,一系列不同取代的烯丙基羧酸酯,如烷基和环烷基,均可顺利进行反应,获得相应的产物3a-3h,收率为53-88%。含有环醚、硫醚或乙烯缩酮基团的烯丙基羧酸酯底物,也与体系兼容,获得相应的产物3i-3j,收率为73-86%。然而,具有二级烷基取代基或内烯取代的烯丙基羧酸酯,在标准反应条件下未能进行反应。其次,当底物1中的R1为一系列不同电性取代的芳基、萘基、烷基与环烷基时,均可顺利进行反应,获得相应的产物3l-3v,收率为42-81%。此外,含有一级、二级和三级烷氧羰基取代的底物2,也与体系兼容,获得相应的产物3w-3y,收率为63-69%。一系列溴二氟乙酰胺,如N-二乙基、哌啶基、吗啉基、N-金刚烷基和N-苯基溴二氟乙酰酰胺,均为合适的底物,获得相应的产物3z-3ad,收率为54-79%。溴代全氟烷也与体系兼容,获得相应的产物3ae-3af,收率为67-68%。同时,在标准条件下,一系列复杂分子,如丙磺舒、胆酸、利鲁唑、维生素E、L-薄荷醇、二酮果糖(diactonefructose)、二丙酮-D-葡萄糖和薯蓣皂苷元|(diosgenin)衍生物,均可顺利进行反应,获得相应的产物3ag-3an,收率为48-84%(Table 3)。紧接着,作者对反应的实用性进行了研究(Scheme 1)。首先,克级规模实验,同样能够以82%收率得到产物3a。其次,3a可进行多种转化。3a在DBU/DMSO条件下进行选择性HBr消除,可以70%的收率得到末端烯烃衍生物4。3a在NaBH4/MeOH条件下进行还原反应,可以76%的收率得到醇衍生物5。3a在K2CO3/MeOH/H2O条件下进行水解反应,可以62%的收率得到羧酸衍生物6。3a在NH3/MeOH条件下进行水解反应,可以62%的收率得到酰胺化衍生物7。此外,作者还对反应机理进行了进一步的研究(Figure 2)。首先,自由基捕获与自由基钟实验表明,反应可能涉及自由基的机理(Figure 2A)。对照实验表明,1,2-溴二氟烷基化合物9不是反应的中间体(Figure 2B)。交叉实验表明,酰氧基转移可能通过协同机理进行(Figure 2C)。氘代实验表明,[1,2]-和[2,3]-酰氧基转移途径可能同时起作用(Figure 2D)。光开关实验和量子产率测量表明,反应不太可能涉及自由基链机理。其次,19F NMR滴定实验表明,随着dppm浓度的增加,显示出高场偏移,这一观察表明膦孤对电子给到2a的C-Br键的反键轨道中,这增加了α-碳和氟原子屏蔽处的电子密度(Figure 2E)。Job’s点(Figure 2F)与Benesi-Hildebrand点(Figure 2G)研究表明,反应以1:1的比例形成了dppm−2a,两者的缔合常数(KEDA)为0.16 M−1。此外,理论计算研究表明,反应涉及光诱导生成Br-膦基自由基(II)和烷基自由基(III)的生成、自由基加成、1,2-RaM与溴原子转移的过程(Figure 2H)。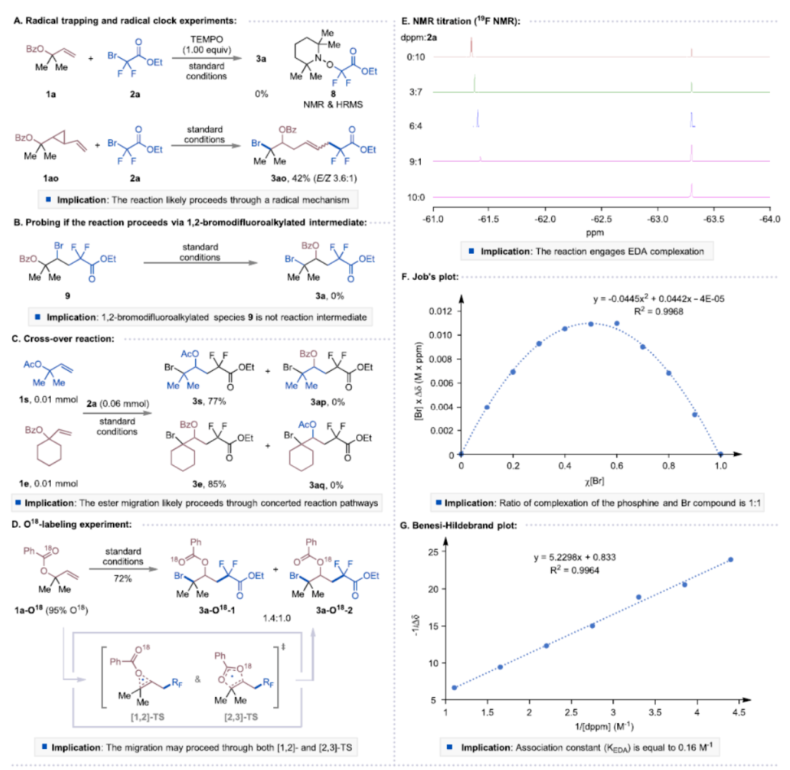

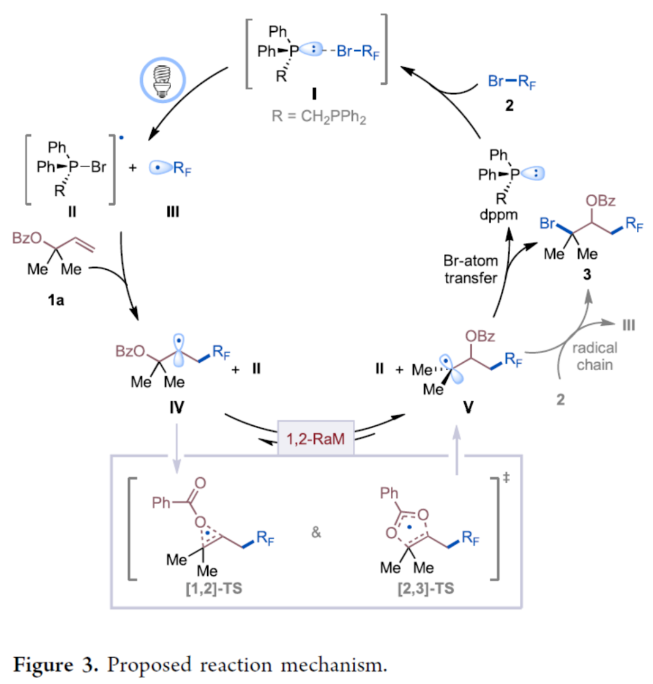
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 3)。首先,配合物I或其Na2CO3加合物在光激发下生成溴膦基自由基配合物II和二氟烷基自由基III。随后,III与1a经自由基加成后生成二级烷基自由基IV。中间体IV经协同的[1,2]-和[2,3]-苯甲酰氧基位移([1,2]-TS和[2,3]-TS),生成了更稳定的三级自由基中间体V。最后,从溴膦配合物II(或2)到自由基中间体V的溴原子转移,可获得所需的产物3,并再生dppm,从而关闭催化循环。美国纽约州立大学Ming-Yu Ngai与埃默里大学Djamaladdin G. Musaev课题组首次报道了一种可见光诱导膦催化烯丙基羧酸酯的1,3-碳溴化反应,合成了一系列具有价值的取代的异丙基羧酸酯衍生物。同时,该策略具有广泛的官能团耐受性、适用于一系列复杂分子的后期修饰等优势。初步的机理研究表明,一种非链式自由基机理涉及dppm-2a配合物及其Na2CO3加合物的形成、1,2-RaM和溴原子转移过程。文献详情:
Gaoyuan Zhao, Sanghyun Lim, Djamaladdin G. Musaev,* Ming-Yu Ngai*. Expanding Reaction Profile of Allyl Carboxylates via 1,2-Radical Migration (RaM): Visible-Light-Induced Phosphine-Catalyzed 1,3-Carbobromination of Allyl Carboxylates. J. Am. Chem. Soc. 2023, https://doi.org/10.1021/jacs.2c11867
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn