

(图片来源:J. Am. Chem. Soc.)
正文
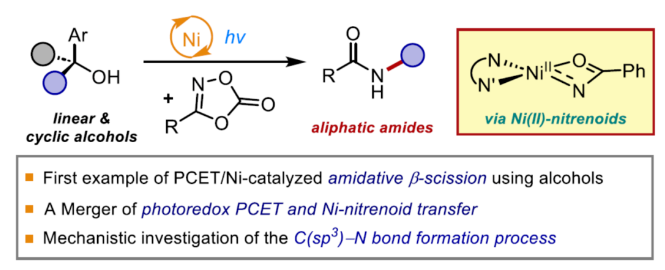
近年来,化学家们对光氧化还原/镍双重催化体系进行了大量的探索。其中,有两种主要的策略来生成关键的烷基-Ni(III)-N配合物,以促进C(sp3)-N键的形成。第一种方法涉及将Ni(I)-烷基配合物氧化加成到胺亲电试剂中以形成关键的烷基-Ni(III)-N配合物。该过程利用氢原子转移(HAT)从简单烷烃生成烷基自由基(Scheme 1a)。第二种方法是通过单电子转移(SET)从烷基三氟硼酸盐生成烷基自由基。这些自由基随后与Ni(II)-胺基(amido)配合物进行自由基偶联,从而形成关键的烷基-Ni(III)-N中间体。到目前为止,尽管在双重光氧化还原/Ni-催化的C(sp3)-酰胺化领域取得了显著进展,但对于通过Ni(II)-类氮宾参与自由基加成的策略仍有待进一步的探索。前期,化学家们利用空间位阻大的配体通过镍-氮宾中间体实现了C-N键的构建。Sukbok Chang课题组设想,是否可以利用1,4,2-二噁唑-5-酮作为Ni(II)-类氮宾的前体来捕获光氧化还原生成的烷基自由基,从而实现简单配体存在下的分子间酰胺化反应(Scheme 1b)。近日,韩国科学技术院Sukbok Chang课题组利用二噁唑酮作为Ni(II)-类氮宾前体,通过质子耦合电子转移(PCET)与镍双重催化,首次实现了脂肪族酰胺的合成(Scheme 1c)。该策略能够实现环状或非环状醇的C(sp3)-酰胺化,提供了一种合成有价值的脂肪族酰胺的新途径。综合实验和计算研究表明,作者假设的(κ2-N,O)Ni(II)-类氮宾配合物能够有效的捕获碳中心自由基,这些自由基又经历了内球层(inner-sphere)类氮宾转移,形成了区域专一性的C-N键。下载化学加APP到你手机,更加方便,更多收获。

(图片来源:J. Am. Chem. Soc.)
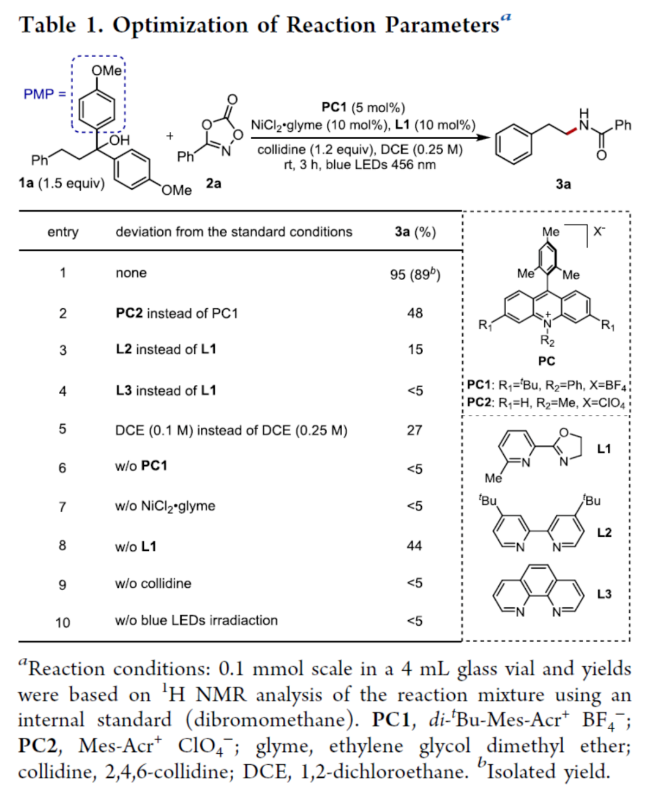
首先,作者以1,1-双(4-甲氧基苯基)-3-苯基丙-1-醇1a与二噁唑酮衍生物2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以PC1(5 mol %)作为光催化剂,NiCl2·glyme(10 mol %)作为金属催化剂,L1(10 mol %)作为配体,2,4,6-三甲基吡啶(1.2 equiv)作为碱,蓝色LEDs(456 nm)作为光源,在DCE溶剂中室温反应3 h,可以89%的分离收率得到酰胺产物3a。
(图片来源:J. Am. Chem. Soc.)
在获得上述最佳反应条件后,作者对直链二级与三级醇底物的范围进行了扩展(Scheme 2)。首先,含有β-苯基取代的三级醇,均可与2a顺利反应,获得相应的产物3a-3g,收率为44-89%。值得注意的是,该策略代表了三级直链醇进行酰胺化的首次催化C-C键断裂的例子。其次,含有烷基取代或二苄基氨基取代的三级醇底物,也是合适的底物,获得相应的产物3h-3j,收率为41-71%。此外,一系列二级醇底物,也能够顺利进行反应,获得相应的产物3k-3n,收率为27-77%。

(图片来源:J. Am. Chem. Soc.)
紧接着,作者对三级环烷基醇底物的范围进行了扩展(Scheme 3)。首先,具有不同环尺寸的三级环烷基醇底物,均可与2a顺利进行反应,获得相应的产物5a-5k,收率为24-96%。其中,反应效率不受环尺寸的影响,如5a-5e。然而,取代环己醇衍生物的反应相当缓慢(5f和5g)。同时,环内含有氧或氮等杂原子的底物,也与体系兼容,如5h-5k。值得注意的是,对于在环中具有杂原子的非对称底物(4j和4k),观察到键断裂仅发生在氧或氮原子的α-位置(5j和5k)。这种区域选择性归因于C−C键的β-断裂产生的假定自由基中间体的相对稳定性的差异。其次,含有芳基取代的环状烷基醇,也是合适的底物,获得相应的产物5l-5p,收率为40-81%。

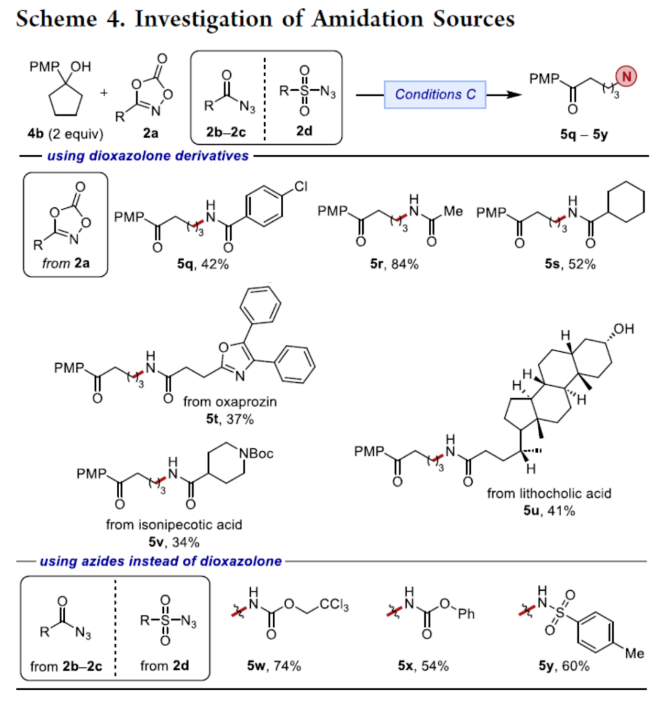
随后,作者对酰胺源进行了研究(Scheme 4)。首先,含有芳基、甲基或环己基取代的二噁唑酮衍生物,均可与4b顺利进行反应,获得相应的产物5q-5s,收率为42-84%。其次,该策略还可用于一些药物分子的后期衍生化,如奥沙普秦、石胆酸与Isonipecotic acid,获得相应的产物5t-5v,收率为34-41%。此外,羰基或磺酰基叠氮化物,也是有效的底物,获得相应的产物5w-5y,收率为54-74%。
(图片来源:J. Am. Chem. Soc.)
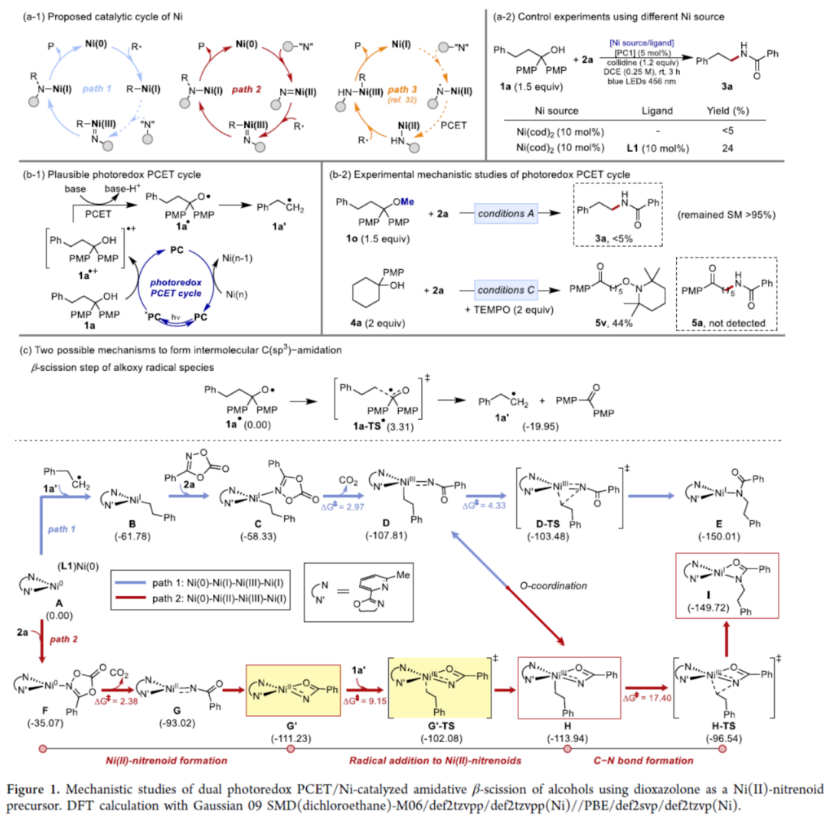
此外,作者还对反应机理进行了进一步的研究(Figure 1)。首先,根据使用不同镍源的控制实验以及相关文献的查阅,在镍催化循环中可能涉及两种途径,即Ni(0)-Ni(I)-Ni(III)-Ni(I)(Path 1)与Ni(0)-Ni(II)-Ni(III)-Ni(I)(Path 2)(Figure a-1)。其次,作者提出了一种可能的光氧化还原PCET循环过程(Figure 1b-1)。在可见光照射下,底物中的芳基部分被PC的激发态氧化,形成瞬态芳烃自由基阳离子(1a•+)。随后,通过分子内PCET过程,可生成烷氧基自由基中间体(1a•),该中间体通过β-断裂转化为活性碳中心自由基1a′。Stern-Volmer分析表明,PC的激发态被CH2Cl2中的醇4a有效淬灭,与三甲基吡啶的存在无关。同时,通过相关的实验研究,进一步证明了上述过程的合理性(Figure 1b-2)。
基于上述的研究以及相关计算研究,作者提出了两种合理的催化循环过程(Figure 1c)。首先,在path 1中,1a′与(L1)Ni(0) A经自由基加成生成烷基Ni(I)中间体B,这在热力学上是有利的。然而,在path 2中,2a与(L1)Ni(0) A结合并释放CO2,生成(κ2-N,O)-键合的Ni(II)配合物G′。有趣的是,当比较Ni(I)中间体B和(κ2-N,O)Ni(II)-氮宾配合物G′之间的相对能量时,后者的显著热力学稳定性可能支持通过path 2形成初始的类氮宾。此外,由于A对二噁唑酮的脱羧过程在动力学上是可行的,(κ2-N,O)Ni(II)-氮宾配合物G是参与二噁唑啉酮活化步骤的催化活性物种。随后,按照path 2,计算出在Ni-类氮宾化合物G′中添加1a′以具有合理的活化能垒(G′-TS),从而得到烷基-Ni(III)-类氮宾化合物H。值得注意的是,尽管设想类氮宾中间体D(path 1)和H(path 2)之间的相互转化,但据计算,中间体H在热力学上比中间体D更可行,这可能是由于额外的羰基配位导致。虽然外球层自由基加成在能量上要求更高,但通过H-TS形成的内球层C-N键是合理的。
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn