

(图片来源:J. Am. Chem. Soc.)
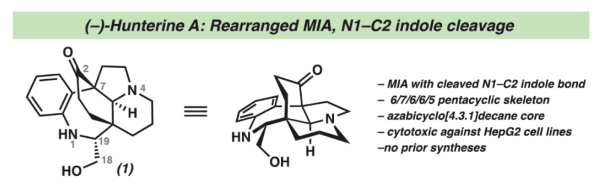
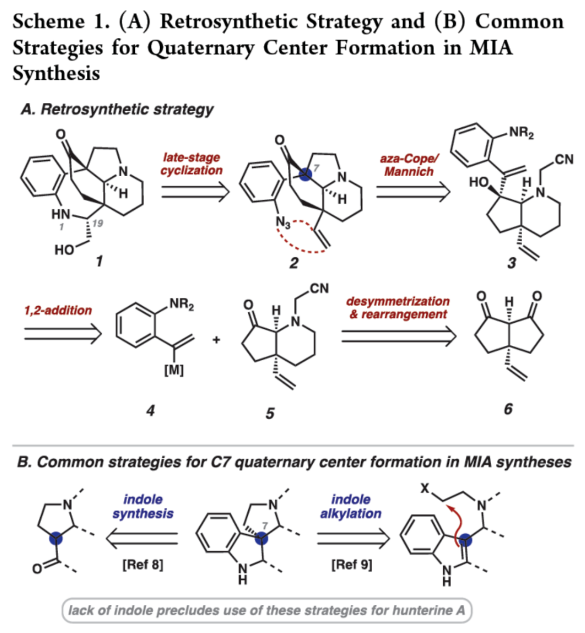
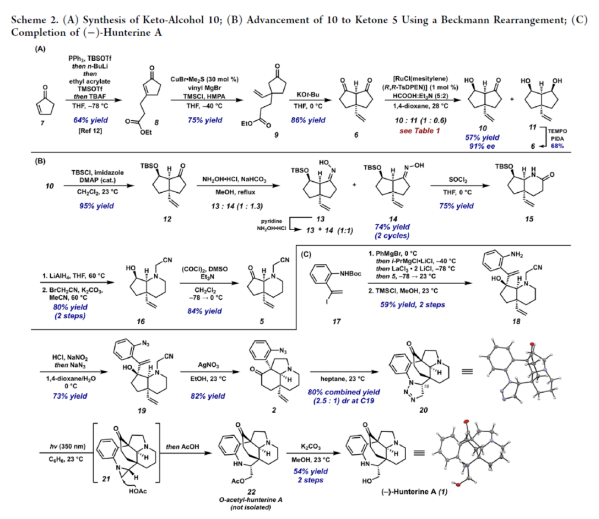
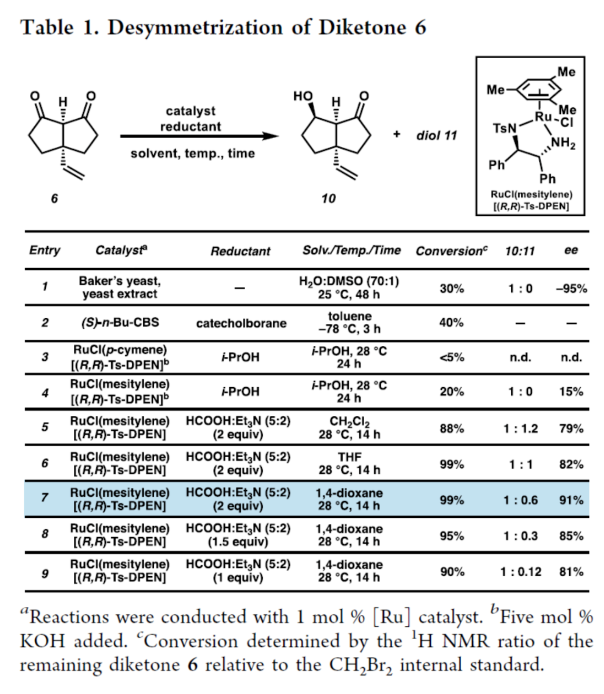
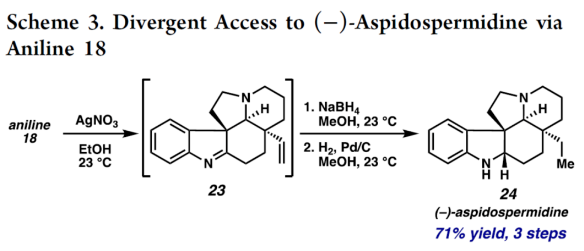
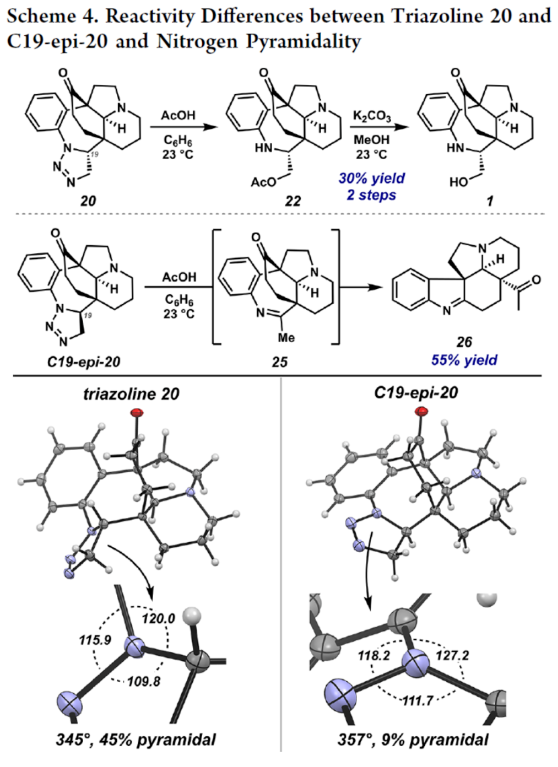
正文 单萜吲哚生物碱(MIAs)是一类结构多样的天然产物,由于其复杂性和多样的生物活性,几十年来引起了合成化学家的注意。该家族中的分子通常以与各种重排的萜烯单元结合的吲哚或吲哚啉为特征(Figure 1)。然而,已分离出少量含有重排吲哚单元的MIAs,其中C2−C7键发生断裂。目前,已经开发了MIA家族成员的许多优雅的全合成方法,包括那些含有C2−C7吲哚断裂的方法。2019年,化学家们成功分离出(−)-Hunterine A(1),其属于一类结构独特的单萜吲哚生物碱,其中N1−C2吲哚键发生断裂(Figure 1)。到目前为止,只有一种结构相关的天然产物被分离出来,并且没有任何相应的合成报道。从合成的角度来看,桥联氮杂双环[4.3.1]癸烷骨架、N1和C18醇的不和谐氧化模式(dissonant oxidation pattern)以及C19立体化学都存在挑战。此外,1对HepG2肝癌细胞系(35 μM)具有中等的细胞毒性活性。因此,仍需开发一种合成Hunterine A的独特合成方法。下载化学加APP到你手机,收获更多商业合作机会。 (图片来源:J. Am. Chem. Soc.) 首先,作者进行了相关的逆合成分析(Scheme 1A)。(−)-Hunterine A(1)可由砌块2经后期环化反应制备。砌块2可由砌块3经aza-Cope/Mannich重排反应制备。砌块3可由砌块4与砌块5经汇聚性与非对映选择性1,2-加成反应制备。砌块5可由对称双环二酮6经去对称化与重排反应制备。值得注意的是,通过aza-Cope/Mannich重排反应,可实现C7全碳季碳中心的构建(Scheme 1B)。 (图片来源:J. Am. Chem. Soc.) 砌块10的合成(Scheme 2A)。以环戊烯酮7为底物,分别在TBSOTf、n-BuLi、丙烯酸乙酯/TMSOTf以及TBAF条件下进行加成反应,可以64%的总收率得到烯酮中间体8。通过对反应条件的多次尝试后发现,中间体8与乙烯基溴化镁在CuBr•Me2S/ TMSCl/HMPA条件下进行1,4-加成反应,可以75%的收率得到中间体9。中间体9在KOt-Bu/THF条件下进行分子内Claisen缩合反应,可以86%的收率得到对称二酮中间体6。通过对反应条件的优化后发现(Table 1),当以RuCl(mesitylene)[(R,R)-TsDPEN](1 mol %)作为催化剂,HCOOH : Et3N(5:2)作为还原剂,1,4-二氧六环作为溶剂,在28 oC下反应14 h,中间体6可顺利进行所需的不对称还原反应,可以57%的收率与91% ee得到酮醇中间体10以及二醇中间体11(过度的还原导致)。值得注意的是,该策略是对称[3.3.0]二酮的非酶对映选择性还原的首次报道。同时,二醇中间体11在TEMPO/PIDA条件下进行氧化反应,可以68%的收率得到中间体6。 砌块5的合成(Scheme 2B)。二醇中间体11在TBSCl/咪唑/DMAP条件下进行羟基的保护,可以95%的收率得到硅醚中间体12。中间体12在NH2OH•HCl/NaHCO3/ MeOH条件下进行羟胺缩合反应,可获得肟异构体的混合物13和14,比例为1:1.3。同时,上述的两种异构体可通过色谱分离,然后将异构体13重新置于肟形成条件下,可再次分离的1:1混合物。通过两次的循环后,可以74%的收率得到肟中间体14。中间体14在SOCl2/THF条件下进行Beckmann重排反应,可以75%的收率得到内酰胺中间体15。中间体15在LiAlH4/THF条件下进行还原反应,并在K2CO3/MeCN条件下与溴乙腈进行选择性烷基化反应,可以两步80%的总收率得到氨基腈中间体16。中间体16在草酰氯/DMSO/Et3N条件下进行Swern氧化反应,可以84%的收率得到双环酮中间体5。 (−)-Hunterine A(1)的全合成(Scheme 2C)。通过对反应条件的多次尝试后,乙烯基碘化物17分别在PhMgBr、i-PrMgCl•LiCl以及LaCl3•2LiCl进行去质子化和镁卤素交换后,再加入双环酮中间体5,并在TMSCl/MeOH条件下进行脱保护,可以两步59%的总收率得到中间体18。值得注意的是,LaCl3•2LiCl是促进双负离子1,2-加成的关键。中间体18在HCl/NaNO2/NaN3条件下进行缩合反应,可以73%的收率得到芳基叠氮化物19。中间体18在AgNO3/EtOH条件下进行aza-Cope/Mannich反应,可以82%的收率得到三环叠氮化物2。值得注意的是,该策略首次成功实现了在叠氮化物存在下进行aza-Cope/Mannich反应。令人高兴的是,简单地将叠氮化物2溶解在庚烷中,可在室温下自发进行叠氮化物-烯烃偶极环加成反应,可以80%的收率得到三唑啉中间体20,为在C19-位可分离的非对映异构体的2.5:1混合物。中间体20在350 nm光照以及乙酸条件下进行区域选择性开环反应,并在K2CO3/MeOH条件下进行脱乙酰化反应,可以两步54%的总收率得到(−)-Hunterine A(1)。 (图片来源:J. Am. Chem. Soc.) (图片来源:J. Am. Chem. Soc.) 同时,作者发现,以砌块18为底物,还可实现了(−)-Aspidospermidine的全合成(Scheme 3)。中间体18在AgNO3/EtOH条件下进行aza-Cope/Mannich反应(生成中间体23),并在NaBH4/MeOH以及Pd/C/H2条件下进行还原反应,可以三步71%的总收率得到(−)-Aspidospermidine 24。 此外,作者还对三唑啉中间体20与C19-epi-20的反应性差异进行了研究(Scheme 4)。研究结果表明,当使用C19-epi-20为底物时,反应可通过中间体25,以55%的收率形成亚胺化合物26。这种反应性的差异与各个氮原子的不同金字塔度(degrees of pyramidality)有关。20的晶体结构中的相关键角的总和表明,氮原子是45%的金字塔状,而在C19-epi-20中,氮原子仅是9%的金字塔状。因此,由C19-epi-20形成亚胺26(可能通过中间体亚胺25)可能反映了这种非对映异构体保持平面几何形状的倾向。 (图片来源:J. Am. Chem. Soc.) 总结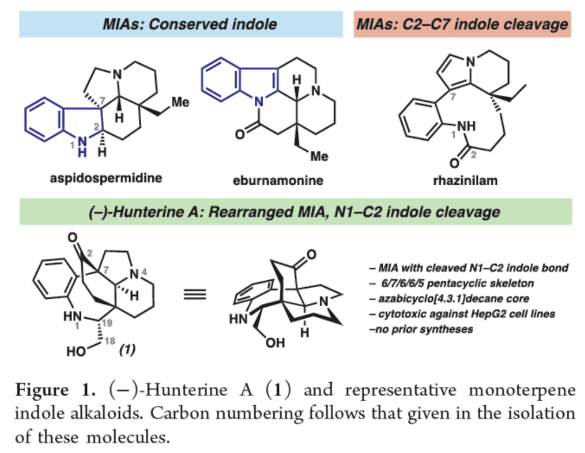
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn