

(图片来源:Angew. Chem. Int. Ed.)
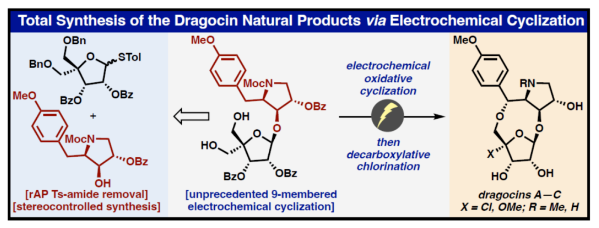
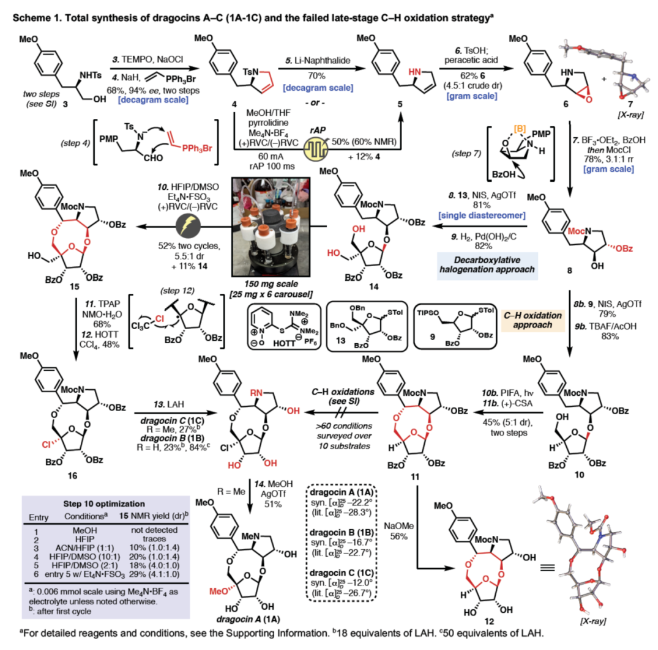
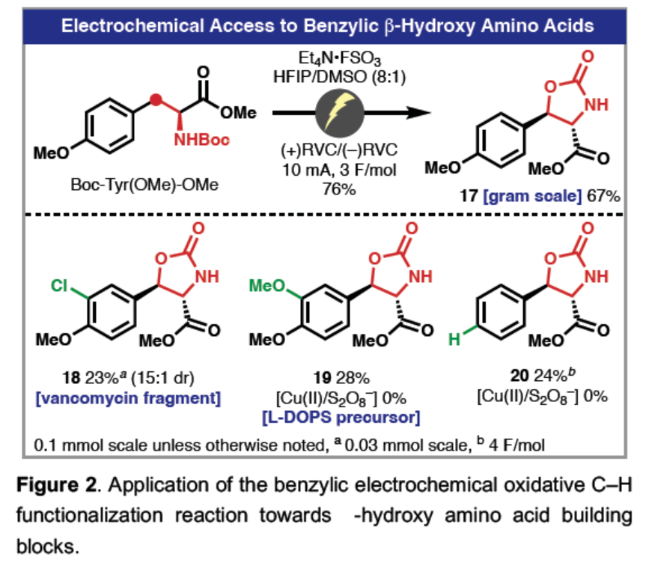
正文 Dragocins A–C(1A-1C,Figure 1)属于一类特殊的次生代谢产物的杂交结构。这些有趣的分子是从Boca del Drago附近的加勒比海海岸一种海洋蓝细菌中分离出来的,并对人类肺癌细胞具有适度的细胞毒性活性(H-460)。到目前为止,与Dragocin家族唯一相关的天然产物是AB3217-A(2)(之前由Nakata通过26步合成),这是一种抗螨化合物(anti-mite substance),具有几乎相同的骨架,但缺乏Dragocins A-C上独特的C-4'氧化作用。值得注意的是,这种C-4’官能团化在天然产物空间中是前所未有的,但核杀菌素(nucleocidin,一种C-4’氟化核苷)除外。除了这一不同寻常的特征外,Dragocins还含有一个九元环骨架,该骨架由一个高度氧化的吡咯烷组成,该吡咯烷具有四个连续的手性中心和一个富含电子的芳烃,所有这些都结合在极性核糖部分上。近日,美国Scripps研究所Phil S. Baran课题组利用前所未有的电化学氧化环化策略,首次实现了Dragocins A–C的全合成,涉及13-14步的反应。下载化学加APP到你手机,收获更多商业合作机会。 首先,作者尝试了多种不同的环化策略(Figure 1)。在策略1中,由于无环前体的不稳定性,导致直接通过[3+2]环加成构建九元环骨架的失败。在策略2中,通过分子内糖基化策略,但完全官能团化的前体没有形成所需的九元环骨架。在策略3中,通过呋喃去芳构化方法,以低收率得到不期望的内环化产物而失败。最终,作者利用氧化环化以及脱羧卤化策略,从而实现所需分子的构建。 (图片来源:Angew. Chem. Int. Ed.) 吡咯烷砌块8的合成(Scheme 1)。以D-酪氨酸衍生的醇3为初始底物,在TEMPO/NaOCl条件下进行氧化以及在NaH/乙烯基三苯基溴化膦条件下进行环化反应,可以两步68%的收率得到二氢吡咯中间体4,ee为94%。中间体4在Li/Napthalene条件下进行脱去Ts保护基,可以70%的收率得到中间体5。同时,作者还开发了一种更为安全的替代方法,即在所开发的电化学条件下,可以50%的收率得到中间体5。值得注意的是,该电化学策略作为rAP波形(rAP waveform)在全合成中的首次使用。中间体5在TsOH/PAA条件下进行非对映选择性环氧化反应,可以62%的收率得到环氧化中间体6,dr为4.5:1。中间体6在BzOH/BF3•OEt2以及MocCl条件下进行开环以及保护反应,可以78%的收率得到吡咯烷中间体8,rr为3.1:1。 九元环砌块15的合成。在获得了关键的吡咯烷中间体8后,作者探索了两种不同的方法对C-4’氧化进行了研究,即C-H氧化与脱羧氯化反应。在第一种方法中,中间体8与TIPS保护核糖9在AgOTf/NIS条件下进行糖基化反应(收率为79%),并在TBAF/AcOH条件下进行脱硅化反应(收率为83%),可以两步65%的总收率得到环化前体10。环化前体10在PIFA/hν以及(+)-CSA条件下进行环化反应,可以两步45%的总收率得到九元环中间体11,dr为5:1。然而,中间体11在一系列C-H氧化条件下反应,均未能生成目标的Dragocin B和Dragocin C。同时,中间体11在NaOMe条件下进行脱保护,可以56%的收率得到化合物12。在第二种方法中,中间体8与苯甲酰基保护的糖基供体13在AgOTf/NIS条件下进行糖基化反应(收率为81%),并在H2/Pd(OH)2/C条件下进行脱苄基化反应(收率为82%),可以两步66%的总收率得到环化前体14。通过对电化学氧化环化反应条件的大量筛选后发现,环化前体14在HFIP/DMSO/Et4N•FSO3与(+)RVC/(–)RVC条件下进行化学选择性电化学环化反应,通过两个循环后,可以两步52%的总收率得到九元环中间体15,dr为5.5:1。 Dragocin B和Dragocin C的全合成。中间体15在TPAP/NMO•H2O以及HOTT/CCl4条件下进行脱羧氯化反应,可以两步32%的总收率得到三级氯化物中间体16。中间体16在LAH条件下进行还原反应,可分别以27%的收率得到Dragocin B(1B)和以84%的收率得到Dragocin C(1C)。其中,1B的[���]25 D为-16.7°,而文献中Dragocin B的[���]25 D为-22.7°。1C的[���]25 D为-12.0°,而文献中Dragocin C的[���]25 D为-26.7°。 Dragocin A的全合成。Dragocin C(1C)在MeOH/AgOTf条件下可将C-4’-Cl与-OMe进行交换,可以51%的收率得到Dragocin A(1A)。其中,1A的[���]25 D为-22.2°,而文献中Dragocin A的[���]25 D为-28.3°。 (图片来源:Angew. Chem. Int. Ed.) 此外,作者还对上述的新型电化学方法的实用性进行了研究(Figure 2)。通常,对于合成苄基β-羟基氨基酸的典型条件存在反应性较差以及多步反应。作者发现,通过对上述条件的优化,该电化学环化条件可成功合成一系列噁唑烷衍生物17-20,收率为23-67%。同时,上述的产物是合成官能团化的β-羟基氨基酸的砌块。 (图片来源:Angew. Chem. Int. Ed.) 总结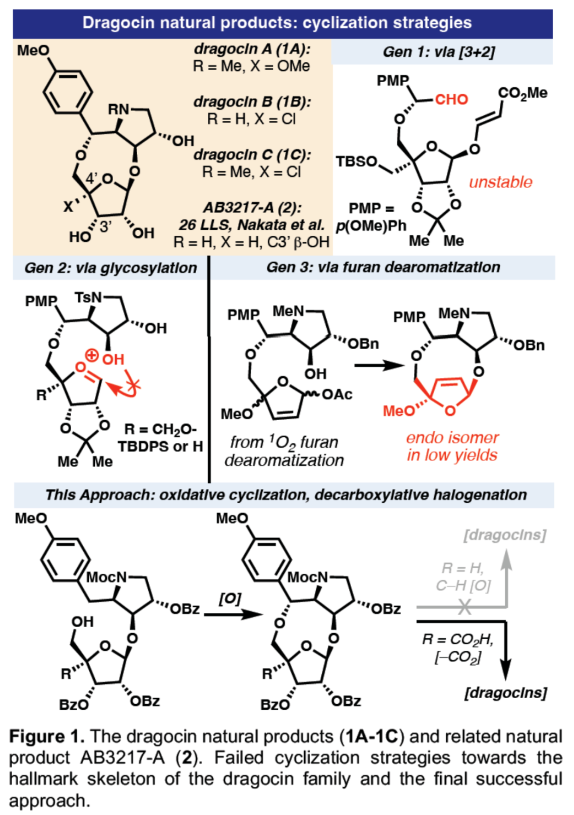
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn