- 首页
- 资讯
Nat. Chem.:金属催化的官能团复分解反应,实现羧酸的碳同位素标记
来源:化学加原创 2024-02-27
导读:近日,美国默克公司(Merck & Co., Inc.,)Donald R. Gauthier Jr与加拿大麦吉尔大学(McGill University)Bruce A. Arndtsen课题组联合发展了利用金属催化的官能团交换来直接实现含羧基药物的碳同位素标记。该转化使用简单易得的固体碳同位素标记的羧酸,在无需使用辐射性气体的条件下一锅法实现了含羧基药物的碳同位素标记。反应中利用镍可以可逆的活化C-Cl的能力以及有机分子之间的官能团交换能力实现了酰氯的碳-碳共价键的官能团复分解反应。值得注意的是,作者在无需使用气体或特殊反应设备的情况下即可实现芳基羧酸、烷基羧酸、杂芳基羧酸和烯基羧酸的14C和13C标记。相关成果发表在Nat. Chem.上,文章链接DOI:10.1038/s41557-024-01447-7。
(图片来源:Nat. Chem.)
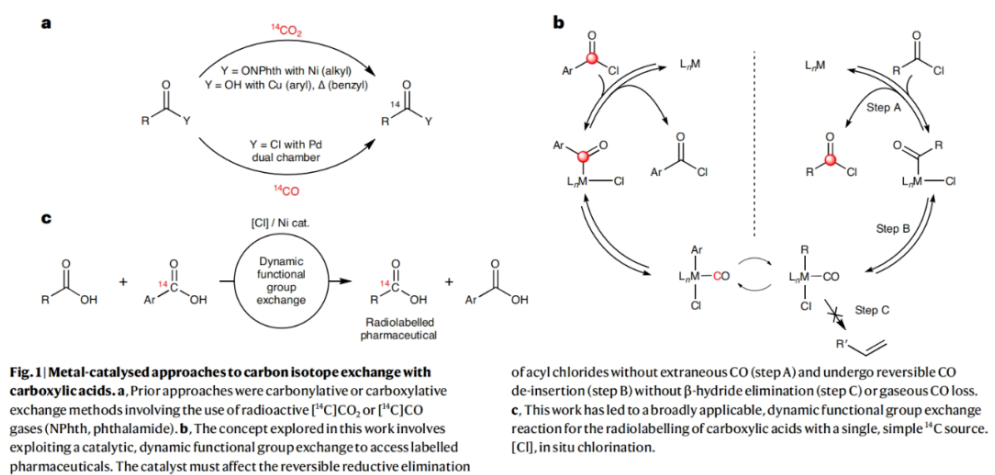
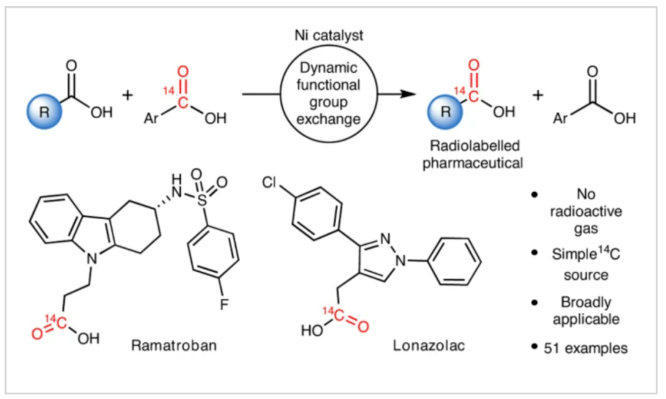
对化合物进行药代动力学性质评估是所有药物研发的基础。而临床前的吸收、分布、代谢和排泄(ADME)研究通常要用到放射性同位素标记的药物。在药物的临床开发中,大多数分子均需要进行14C标记。然而,将放射性同位素引入到药物分子中通常需要使用[14C]CO和[14C]CO2等具有毒性的放射性气体。因此,这为药物分子的14C标记带来一定的困难。近日,美国默克公司Donald R. Gauthier Jr和加拿大麦吉尔大学Bruce A. Arndtsen课题组联合发展了镍催化的官能团交换反应,利用简单易得的碳同位素源直接实现了羧酸衍生物的碳同位素标记(Fig. 1)。下载化学加APP到你手机,收获更多商业合作机会。首先,作者以[13C]苯甲酰氯和对甲氧基苯甲酰氯作为起始原料,当使用Pd2dba3 (5 mol%), Xantphos (10 mol%), 在C6D6中50 oC反应16小时可以以99%的核磁产率得到13C标记的对甲氧基苯甲酰氯产物[13C]1a。不幸的是,当使用烷基羧酸反应时,仅得到了经历β-H消除的烯烃产物。鉴于此,作者将目光聚焦于不容易发生β-H消除的镍催化体系。当使用L1Ni(CO)3 (5 mol%)或Ni(COD)2 (10 mol%),Bu4NCl,在苯腈中室温反应可以良好的实现相应的碳同位素标记。此外,除了使用酰氯作为试剂外,该反应还可以使用1-氯-N,N,2-三甲基-1-丙烯胺(1-chloro-N,N,2-trimethyl-1-propenylamine,TMCE)作为原位氯化试剂与易于处理且长寿命的固体13C供体或14C供体4-苯基苯甲酸进行碳同位素标记(Fig. 2)。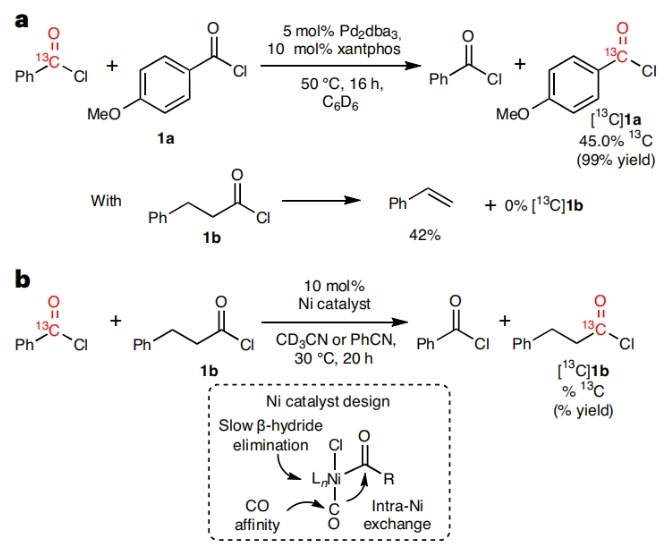
(图片来源:Nat. Chem.)
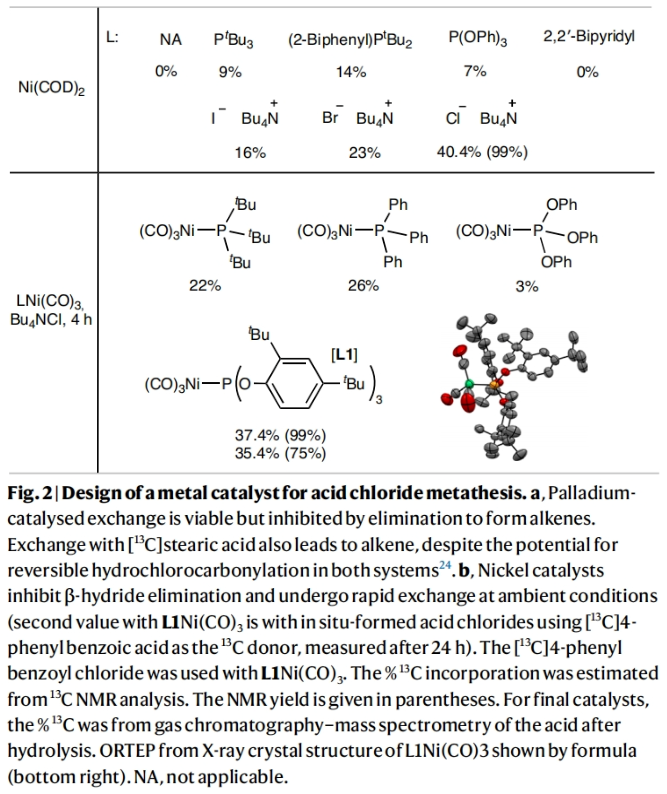
在得到了最优反应条件后,作者对此碳同位素标记策略的底物兼容性进行了考察(Table 1)。实验结果表明一系列不同取代的烷基羧酸、芳基羧酸、杂芳基羧酸以及烯基羧酸均可顺利兼容此反应过程,以21-96%的分离产率得到相应的13C标记产物2b-2z, 2aa-2pp。其中包括呋喃、噻吩、吡咯、内酰胺、酰胺、烷基卤等一系列骨架和基团均可兼容,证明了此转化具有广泛的底物范围。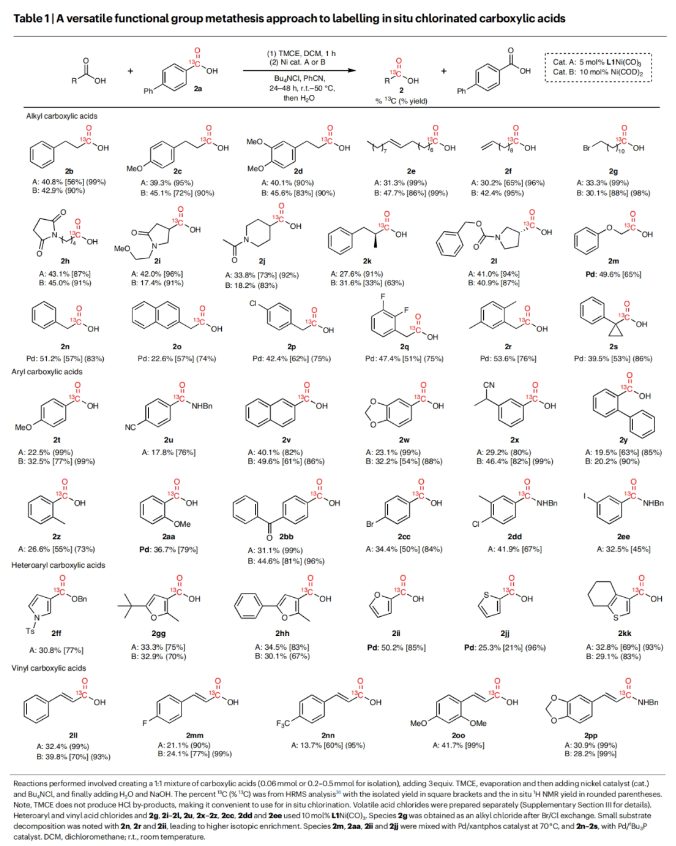
(图片来源:Nat. Chem.)
接下来,作者探索了镍催化的官能团交换过程是如何进行的。通过原位31P NMR监测催化过程,作者发现在整个反应过程中L1Ni(CO)3缓慢消耗以及游离亚磷酸酯逐渐增多(Fig. 3a)。此外,原位13C NMR分析表明13C缓慢对L1Ni(CO)3进行标记(化学位移为194.1 ppm)。游离亚磷酸酯的积累,以及与弱配位配体和添加的氯化物结合的高催化活性,表明氯取代亚磷酸酯对此催化过程至关重要。与这一假设相一致的是,控制实验表明,不含亚磷酸酯的[(CO)3NiCl-][Bu4N+]也是该反应的有效催化剂(Fig. 3b)。尽管这种催化剂并不稳定,且必须原位生成,而加入游离亚磷酸酯与L1Ni(CO)3共催化则抑制了该反应(Fig. 3c)。当在体系中加入自由基捕获剂TEMPO时,反应被完全抑制,并且生成两种酰基-TEMPO加合物,由此表明反应中涉及自由基氧化加成机理(Fig. 3d)。基于上述实验结果,作者提出了此转化可能得反应机理(Fig. 3e):首先,Ni(0)物种I与酰氯通过单电子转移形成酰基自由基,其可以快速重组形成镍-酰基络合物II。络合物II一旦生成,可逆的CO脱除/插入可以实现将标记的碳原子引入到单个镍催化剂的酰基配体上,并且不需要两种金属之间进行交换,也不需要释放CO气体。随后,CO配位的缺电子Ni(II)中间体可能会经历快速的酰氯消除形成Ni(0)络合物,这是反应过程中唯一可观察到的催化剂静息状态(Fig. 3a)。镍上多个CO配体的存在可能促进了CO的快速插入,从而抑制β-H消除过程,进而选择性的生成相应的酰氯产物。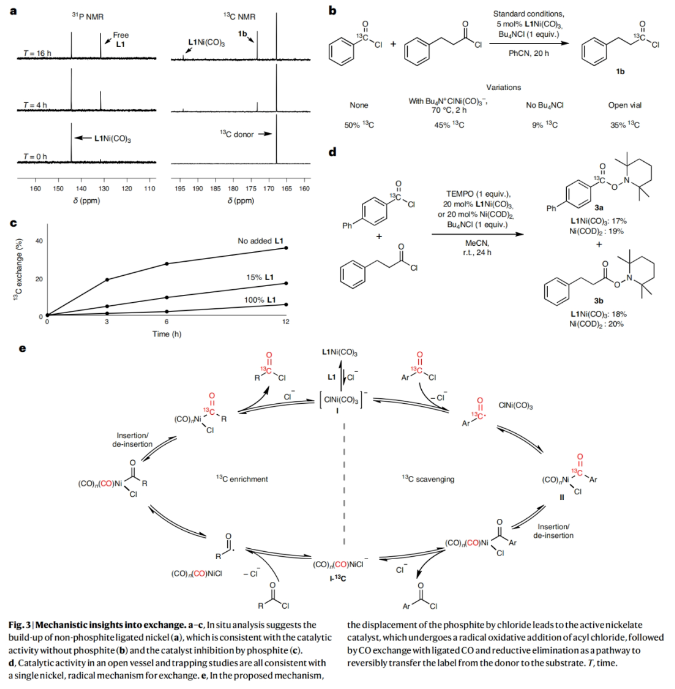
(图片来源:Nat. Chem.)
最后,作者探索了所发展的碳同位素标记策略对生物活性分子的适用性(Table 2)。实验结果表明,perillic acid (4a), jasmonic acid (4b), stearic acid (4c), eicosapent ethyl (4d), GLPG-0974 (4e), probenecid (4f), ramatroban (4g), atorvastatin acetonide (4h), lonazolac (4i), repaglinide (4j)等生物活性分子均可顺利实现转化,以25-83%的分离产率得到相应的碳同位素标记产物,由此证明了此转化的实用性。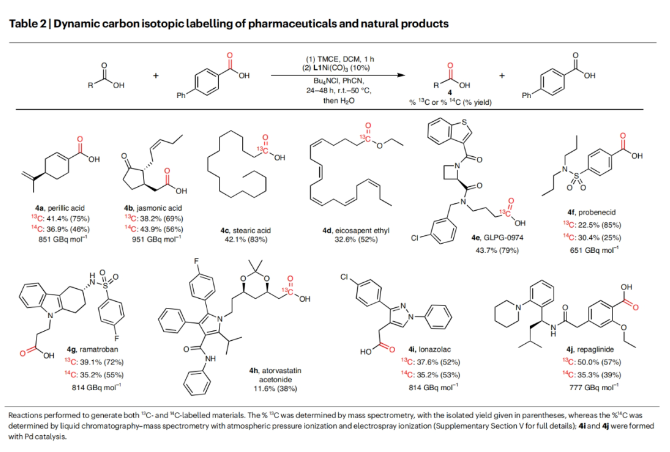
(图片来源:Nat. Chem.)
Donald R. Gauthier Jr和Bruce A. Arndtsen课题组联合发展了镍催化的官能团交换反应,利用简单易得的碳同位素源直接实现了羧酸衍生物的碳同位素标记。反应中通过镍对CO的亲和力来促进酰氯交换并阻止了副反应的发生。该反应可以在简单的环境条件下直接实现芳基羧酸、杂芳基羧酸、乙烯基羧酸、烷基羧酸,包括高度官能团化药物的放射性标记,具有重要的应用价值。文献详情:
R. Garrison Kinney, José Zgheib, Pierre-Louis Lagueux-Tremblay, Cuihan Zhou, Haifeng Yang, Jingwei Li, Donald R. Gauthier Jr*, Bruce A. Arndtsen*. A metal-catalysed functional group metathesis approach to the carbon isotope labelling of carboxylic acids. Nat. Chem., 2024, https://doi.org/10.1038/s41557-024-01447-7.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn