

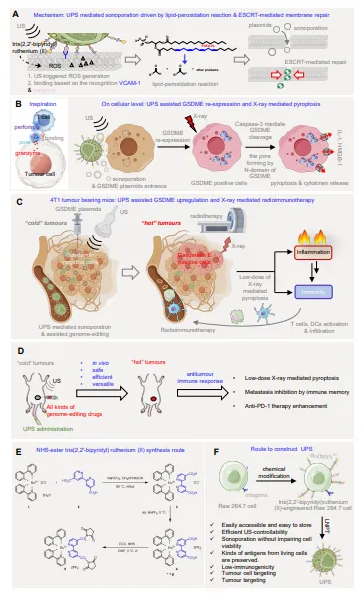
近期,王钦阳实验室继续针对细胞死亡和肿瘤免疫中的重点问题,通过设计仿生的基因编辑辅助系统,顺利地实现了多学科(介入,超声,放疗,免疫)联合下的细胞焦亡介导的抗肿瘤免疫治疗。该工作以题为A T-cell Inspired Sonoporation System Enhances Low-dose X-ray-mediated Pyroptosis and Radioimmunotherapy Efficacy by Restoring Gasdermin-E Expression发表于Advanced Materials。我们的工作不仅可为多学科联合的抗肿瘤治疗提供一个可参考的预临床方案,而且为推进细胞焦亡介导的抗肿瘤免疫治疗提供了可行的预临床路径。此外,该工作还可为设计面向临床的在体基因编辑系统提供新的见解。下载化学加APP到你手机,收获更多商业合作机会。 该工作也是我们在Nature (2020), Nature Communications (2023), Advanced Materials (2023), Advanced Science (2024)后,提供的另一种基于细胞死亡通路设计的仿生溶瘤技术(详见 Advanced Materials, 2024, DOI,https://doi.org/10.1002/adma.202401384) 背景介绍 细胞焦亡是一种由gasdermin蛋白介导的免疫原性细胞死亡。2020年,邵峰院士团队发现肿瘤特异性的细胞焦亡可以有效的激活抗肿瘤免疫功能。因此,细胞焦亡介导的抗肿瘤免疫治疗具有极佳的临床应用前景。 但是,人类的癌细胞普遍通过抑制gasdermin的表达来逃避细胞焦亡。针对这个问题,一种简单且直接的解决方案就是通过基因编辑技术来恢复肿瘤细胞内gasdermin的表达。不幸的是,所有基因编辑药物(如DNA,RNA和蛋白)都难以进入细胞。虽然,在肿瘤治疗领域,基于纳米颗粒的基因编辑药物已被广泛报道并取得了显著的进展。但是,纳米系统的一些固有问题,如“内体逃逸难题”,“肿瘤递送效率约在1%左右”和“脱靶”等,仍困扰着基于纳米颗粒的基因编辑抗肿瘤药物的发展。 实际上,自然界经过长期的进化和选择才形成了我们熟悉的“细胞膜的选择性透过”这一机制。尽管这种机制可能为药物递送带来了不便,但是我们也要看到它的存在对维持机体的微观和宏观的平衡具有重要的意义。有趣的是,当这种平衡需要被打破时,T细胞和噬菌体提供了一种完全不同于纳米颗粒的方式,但其智能性和精确性都令人叹为观止。例如,当T细胞向癌细胞传递颗粒酶时,他们会先靶向癌细胞,然后通过穿孔素介导的生化反应打开细胞膜,从而将颗粒酶精准的递送至靶细胞。因此,通过T细胞仿生技术构建基因编辑辅助系统,建立以细胞膜打开为方式的“基因编辑药物递送”和“功能实现”是值得研究一下的。 工作概要 1. 基于这些观察和我们近期在T细胞仿生技术上的研究积累,这里,我们提供了一种仿T细胞的基因编辑辅助系统UPS。UPS可以识别肿瘤细胞,并在超声的作用下,打开细胞膜,从而使基因编辑药物进入细胞直接发挥编辑作用。UPS的制备超级简单,摇匀洗涤可得。 2. 机制上,UPS在超声的作用下,以脂质过氧化为基础在细胞膜上开出小通道。值得注意的是,超声+UPS介导的ROS产生明显弱于我们最近报道的其他仿生溶瘤系统,这使得UPS辅助的基因编辑成为可能,因为,被编辑的细胞必须在“活下去且活得好”的前提下,才能展示编辑后的功能。当然,这也有赖于癌细胞强大的求生能力(修复功能),因此,ESCRT机制保证了对开孔细胞膜的修复,从而保证了被“打开”细胞在基因递送后的生理活性。 3. 在体外,UPS+US导致多达90%的细胞可被GFP质粒转染,并表达GFP。在体内,UPS主动靶向肿瘤。因此,结合原位注射(或介入注射),UPS+US可以以肿瘤特异性的方式打开肿瘤细胞。体内,多达35%的肿瘤细胞可以被UPS辅助进行基因编辑。值得注意的是,即使注射的质粒泄露在循环系统中,正常细胞的细胞膜将不允许质粒进入,从而,正常细胞没有任何被非靶基因编辑的风险。 4. 我们也成功地将该技术应用于细胞焦亡介导的抗肿瘤免疫。UPS+US+gsdme质粒成功在体内和体外回复了三阴乳腺癌小鼠肿瘤的gsdme的表达。因此,低剂量放疗(5Gy),可显著激活抗肿瘤免疫响应。结合免疫检查点疗法,我们在低剂量放疗下,实现肿瘤清除和抑制转移。
4. X. Hu#, H. Yin#, D. Xie#, T. Chen#, Y. Li, H. Zeng, M. Lu, Q. Wang*, A Bioinspired Immunostimulatory System for Inducing Powerful Antitumor Immune Function by Directly Causing Plasma Membrane Rupture. Adv. Sci. 2024,2305934. doi.org/10.1002/advs.202305934.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn