

摘要
Tetronate类抗生素是一类以乙酰乙酸内酯基团为特征且数量持续增长的天然产物,因其多样的生物活性和特征结构而备受关注。值得注意的是,由环己烯和tetronate片段以螺环方式相连形成的大环化spirotetronate产物,如chlorothricin、kijanimicin和lobophorin A等,是tetronate家族中最具代表性和数量最庞大的成员。其经典的核心结构已被证明遵循统一的生物合成逻辑:在形成成熟的tetronate线性聚酮后,由两步酶促分子内Diels-Alder(IMDA)级联反应完成骨架组装(图1A)。然而,在线性聚醚tetronate类天然产物(如tetronasin和tetronomycin)的生物合成中,催化上述级联D-A反应的两类同源蛋白发挥了不同的功能,依次催化了一步杂D-A反应和一步周环重排(图1B)。这些研究体现了同源生物合成酶在进化过程中的功能创新,从而驱动天然产物的化学多样性。
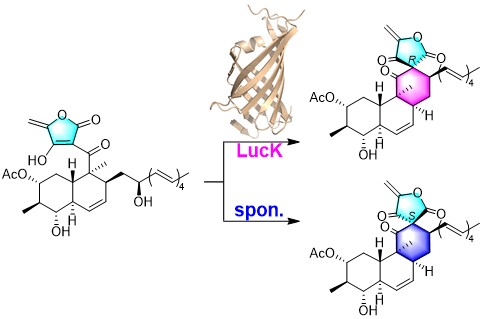
本课题组聚焦非经典tetronate天然产物lucensimycin A,开展生物合成研究,通过体内基因敲除、体外酶学表征、化学衍生化策略和结构生物学手段,完整解析了其生物合成途径,并揭示通过酶促立体选择性亲核取代反应构建非典型螺环骨架的全新机制(图1C),相关成果发表于Journal of the American Chemical Society。
研究内容
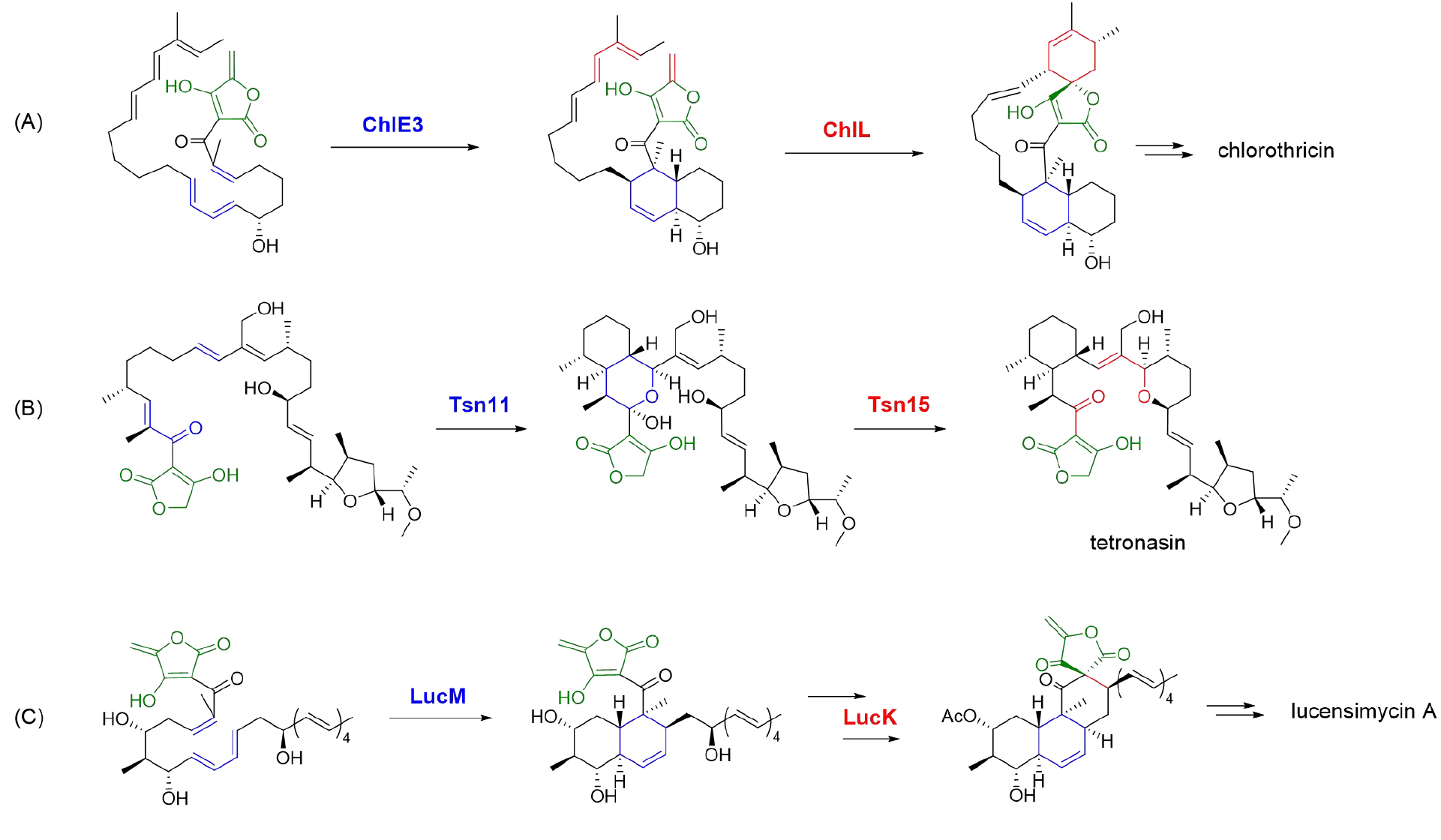
图1
Lucensimycin A(1)的核心结构为罕见的由多氢菲和tetronate以螺环方式相连(spiro[tetronate-hydrophenanthrene])的四环骨架,并且该螺环中心的立体构型长期未被解析。与常规的含有spiro[tetronate-hexene]的spirotetronate类大环化合物的五环结构相比,1的刚性四环结构中含有一个类似的萘环片段,而tetronate基团的环外双键却依旧保留,暗示了其螺环的形成与经典的依赖IMDA反应的螺环形成存在差异,可能涉及独特的环化策略。
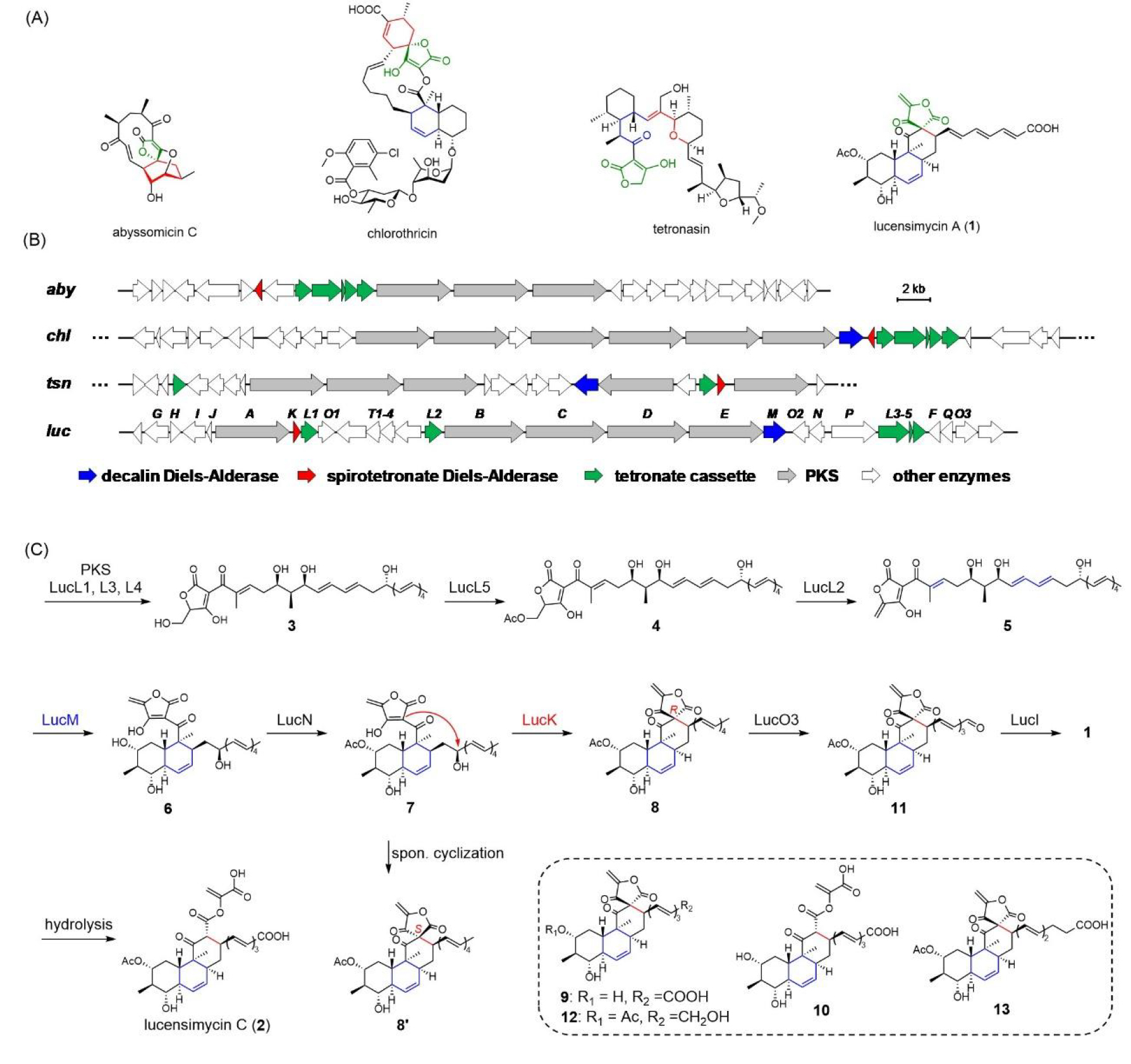
图2
通过基因簇比对发现:lucensimycin A的基因簇(luc)与经典spirotetronate基因簇(chl)高度同源,包含保守的聚酮合酶(PKS)、tetronate形成模块(LucL1-L5)及两类D-A同源酶(LucM/LucK)(图2B)。在对lucL1-L5进行敲除和表达的过程中,研究人员依次鉴定了tetronate成熟过程中关键的羟基(3)、乙酰化(4)和脱水中间体(5),证实其tetronate基团的生物合成遵循保守途径,与abyssomicin、agglomerin等tetronate聚酮的合成策略一致。
LucM与LucK分别和pyrroindolmycin生物合成中的D-A酶PyrE3 (39%/100%)和PyrI4 (22%/62%)同源。lucM的敲除结果表明,LucM作用于tetronate形成模块的下游;结合体外酶反应,进一步证实LucM能够通过endo选择性的IMDA反应,催化线性前体高效构建十氢萘环核心骨架(6)。这一催化过程与PyrE3在pyrroindolmycin生物合成途径中所发挥的功能高度相似。
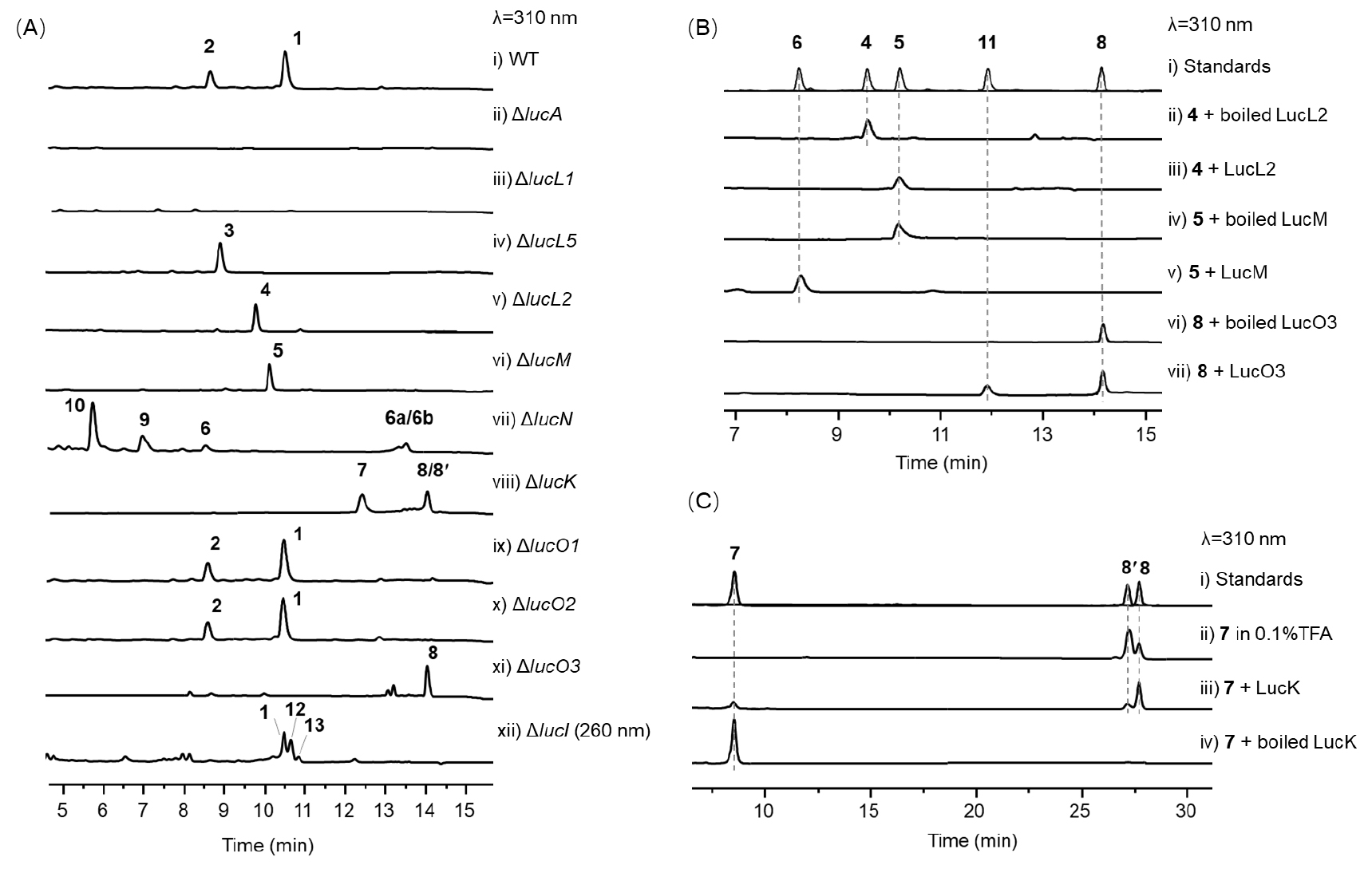
图3
ΔlucK敲除株积累了三个代谢产物7(6的2-羟基乙酰化衍生物)、8和8'。基于NOE分析、DFT 计算和SNAC衍生化,8和8'被证实具有相同的四环平面结构,其差异仅在螺环中心C-12的立体构型(8: 12R;8': 12S)。研究人员发现,7在酸性条件下会迅速自发转化为8和8',转化比例为3:1;而在中性条件下,LucK可高效催化7向8的转化(90% de)。投喂实验显示,仅8能特异性恢复终产物1的产生,证实其为真正的生物合成中间体,并确立1螺环中心的立体构型与8一致。上述实验结果表明,D-A酶同源蛋白LucK在lucensimycin A生物合成过程中,并未识别底物中潜在的D-A反应活性基团,而是罕见地催化了一步分子内亲核取代反应,立体选择性地形成非典型的螺环中心。此外,体内结果表明,LucM与LucK并非连续作用,而是由酰基转移酶LucN对LucM的催化产物乙酰化修饰后,再进行环化。
在完成spiro[tetronate-hydrophenanthrene]四环骨架的构建后,化合物8的四烯链末端仍需经历氧化裂解过程,才能形成终产物1。进一步的敲除实验和体外酶反应证实,LucO3作为首个在非类胡萝卜素天然产物生物合成途径中被表征的类胡萝卜素裂解双加氧酶(CCD),可特异性催化化合物8末端烯烃的氧化断裂,生成醛基中间体;LucI继而催化该醛基氧化为羧酸,最终完成lucensimycin A的生物合成(图2C)。
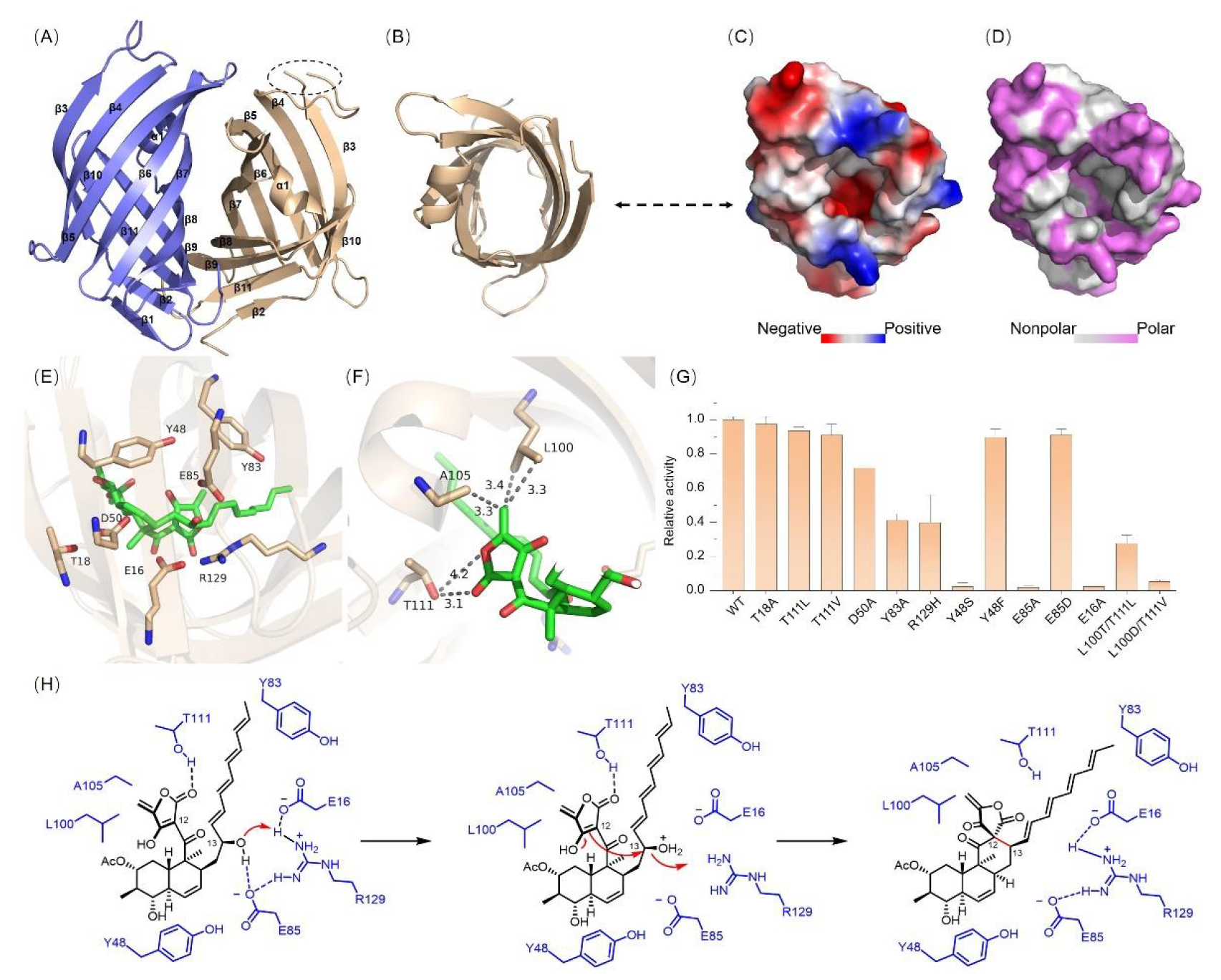
图4
最后,鉴于LucK相较于其同源蛋白在tetronate类天然产物生物合成途径中的特殊催化功能,本研究解析了LucK 1.9 Å的晶体结构,其三维结构呈现保守的β-桶状折叠,通过分子对接和点突变实验,证实其依赖Glu16/Glu85驱动亲核环化反应的酸碱催化机制(图4)。
总结
本研究完整解析了非典型tetronate类天然产物lucensimycin A的生物合成过程。其中,关键的环化酶LucK立体选择性地催化了一步亲核环化反应,从而形成罕见的spiro[tetronate-hydrophenanthrene]四环骨架。针对LucK的结构解析,初步揭示β桶状蛋白通过广义酸碱催化机制介导的全新反应类型,为tetronate类化合物的化学多样性与生物合成之间的关系提供了新见解,同时也暗示了在天然产物生物合成途径中,大量由已充分表征的酶催化剂所介导的非经典酶促转化仍有待进一步发掘。
南京大学化学化工学院博士生奚萌宇为文章第一作者,戈惠明教授和张博副教授为通讯作者。该研究得到了国家自然科学基金委及科技部项目经费的资助。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn