

正文
手性苄醇衍生物是药物和天然产物中重要的结构单元,其立体化学直接影响其生物活性。目前,大多数手性苄醇的合成方法主要集中于构建单手性中心,或仅能合成含两个手性中心结构其中的一种非对映异构体。立体发散性合成含有两个相邻手性中心的苄醇衍生物仍面临挑战。过渡金属催化的不对称苄基取代反应是构建苄位手性中心的有效策略。尽管关键的η3-苄基金属中间体与η3-烯丙基金属在结构上具有等电子体特征,但与广泛发展的不对称烯丙基取代反应(如Tsuji-Trost反应)相比,不对称苄基取代反应的发展显著滞后(图 1A)。其核心挑战在于形成关键 η3-苄基金属中间体所需的去芳构化过程能垒高、条件苛刻。目前已报道的不对称苄基取代反应主要集中于在亲核试剂上构建手性中心。相比之下,在苄位高效、高立体选择性地构筑手性中心仍然十分少见(图 1B)。特别是,利用含氧原子取代的η3-苄基金属中间体来实现苄位立体中心的构建尚未报道。
上海交通大学张万斌教授课题组长期致力于基于双手性金属协同催化策略的立体发散性合成研究。该团队于2016年首次报道了基于Ir/Zn双金属协同催化的立体发散烯丙基取代反应(J. Am. Chem. Soc. 2016, 138, 11093),并随后系统发展了Ir/Cu、Pd/Cu、Ni/Cu等多种双金属催化体系,成功应用于不对称烯丙基取代反应、不对称Heck/Tsuji-Trost串联反应、不对称联烯取代反应、不对称Wacker类型的双碳官能化反应等(J. Am. Chem. Soc. 2018, 140, 2080; J. Am. Chem. Soc. 2020, 142, 8097; J. Am. Chem. Soc. 2021, 143, 12622; Angew. Chem. Int. Ed. 2021, 60, 24941; CCS Chem.2022, 4, 1720;Angew. Chem. Int. Ed. 2023, 62, e202218146; Angew. Chem. Int. Ed. 2023, 62, e202305680; Angew. Chem. Int. Ed. 2023, 62, e202313838; J. Am. Chem. Soc. 2024, 146, 9241; J. Am. Chem. Soc.2024,146, 26121; Angew. Chem. Int. Ed. 2024, 63, e202407498; Science 2024, 385, 972; Angew. Chem. Int. Ed.2025,64, e202508335; J. Am. Chem. Soc. 2025147, 20359-20371;),实现了一系列连续手性中心和非连续手性中心重要手性骨架的立体发散性合成。近年来,该团队将研究拓展至更具挑战性的苄基取代反应(Angew. Chem. Int. Ed. 2022, 61, e202203448; CCS Chem. 2024, 6, 2452),利用双手性金属协同催化策略,成功实现了前手性亲核试剂醛亚胺酯的立体控制,并进一步以外消旋的烷基苄基酯为亲电试剂,同时实现了苄基亲电试剂和亲核试剂上两个手性中心的同时构建以及立体发散性合成。近日,张万斌教授团队成功将苄基偕二醋酸酯用于不对称苄基取代反应中,利用Pd/Cu协同催化体系,实现了苄醇衍生物的立体发散性合成。该反应利用钯催化剂与苄基偕二醋酸酯发生氧化加成,生成关键的氧杂η3-苄基钯中间体;该中间体随后与亲核试剂发生取代反应,高效构建了含有相邻手性中心的手性苄醇衍生物,尤为重要的是,通过精准调控钯、铜催化剂所用手性配体的构型组合,可立体发散性地合成目标产物的所有四种立体异构体(图1C)。
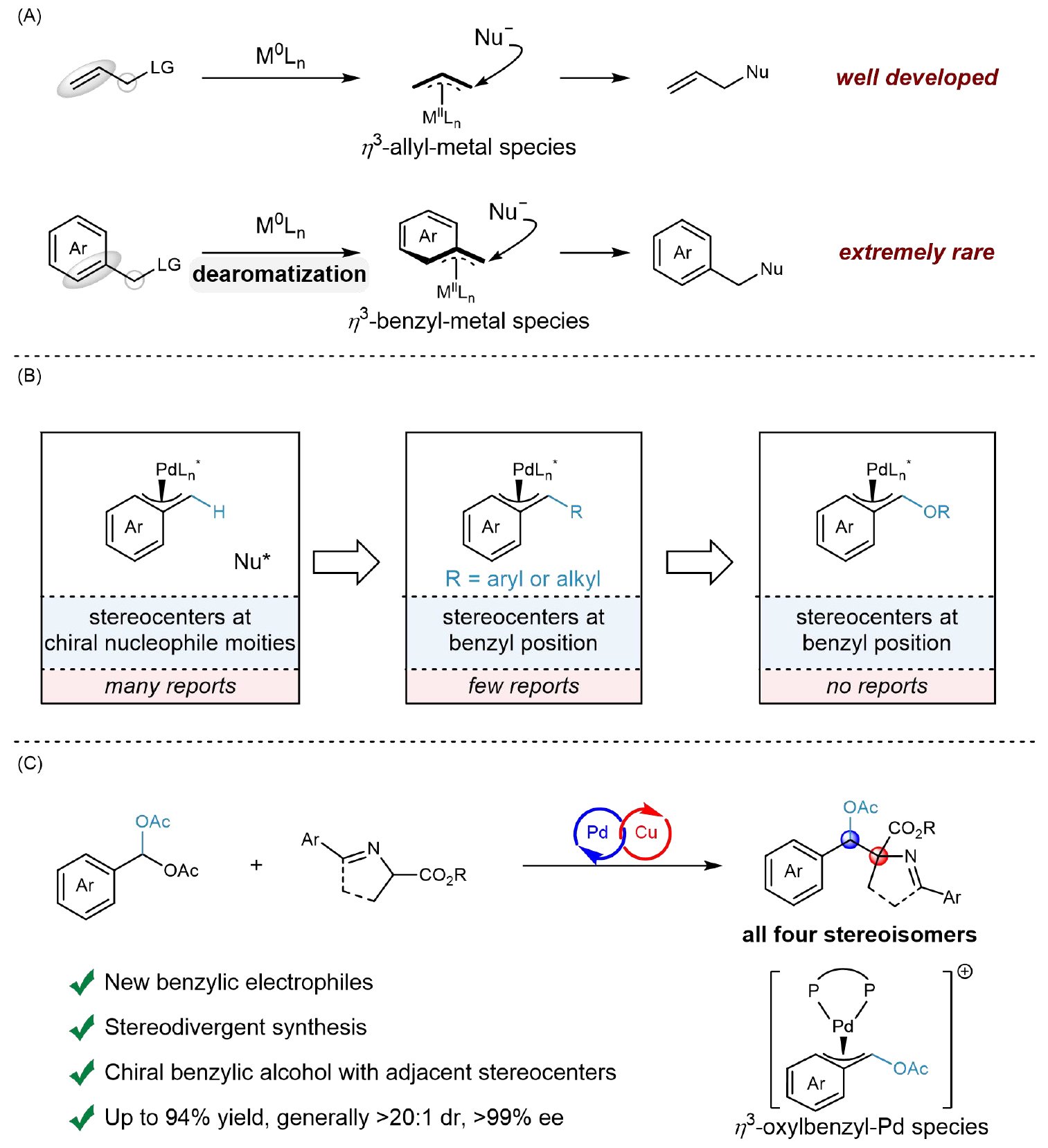
图1过渡金属催化的不对称苄基取代反应
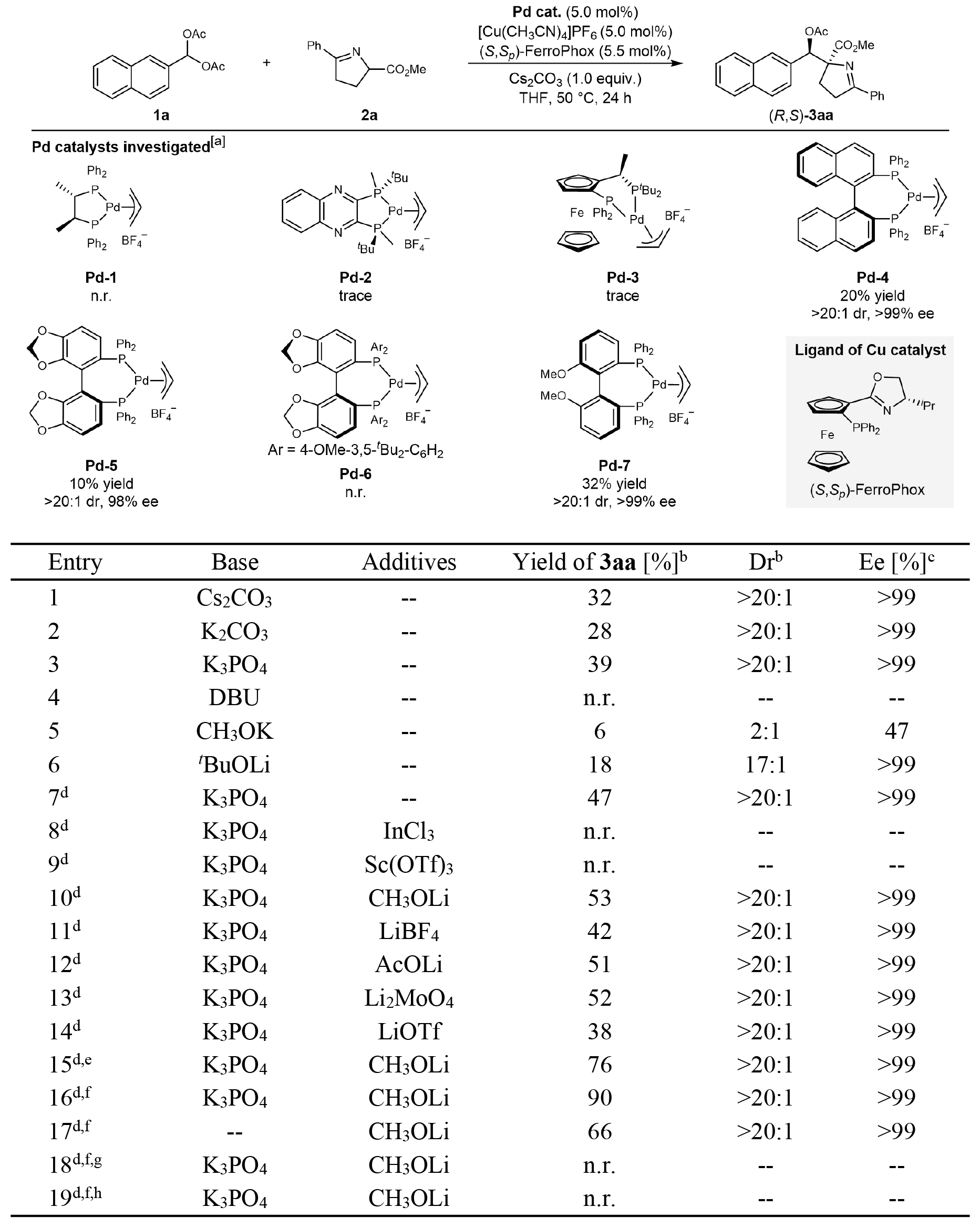
首先,作者以萘甲基偕二醋酸酯(1a)和酮亚胺酯(2a)为模型底物,在Pd/Cu双金属催化体系下进行了反应条件优化(表1)。配体筛选结果表明轴手性双膦配体至关重要,其中采用Pd-7与[Cu(CH3CN)4]PF6/(S,Sp)-FerroPhox组合时,反应能以32%的产率和优异的立体选择性(>20:1dr, >99% ee)获得目标产物(R,S)-3aa。碱的考察发现K3PO4效果较优。然而,反应中存在1a水解生成萘甲醛的副反应,显著限制了产率。引入4Å分子筛有效抑制了水解副反应,将目标产物产率从39%提升至47%。进一步筛选多种锂盐添加剂,发现K3PO4与CH3OLi联用可将目标产物的产率提升至90%,且立体选择性保持不变(>20:1 dr, >99% ee);而单独使用CH3OLi作为碱时效果较差(产率66%)。控制实验证实Pd和Cu催化剂均为该反应所必需催化剂。反应最终确立的最优条件为:以(S)-Pd-7作为钯催化剂,以(S,Sp)-FerroPhox为铜配体,K3PO4与CH3OLi联用,加入4Å分子筛,在THF溶剂中于50 °C反应24小时。
在确立最优条件后,作者探究了反应的立体发散合成能力:通过调整钯/铜双金属催化剂的手性配体构型组合,成功实现了从同一组底物出发的高选择性立体发散合成,获得了产物3aa的所有四种立体异构体(图2)。
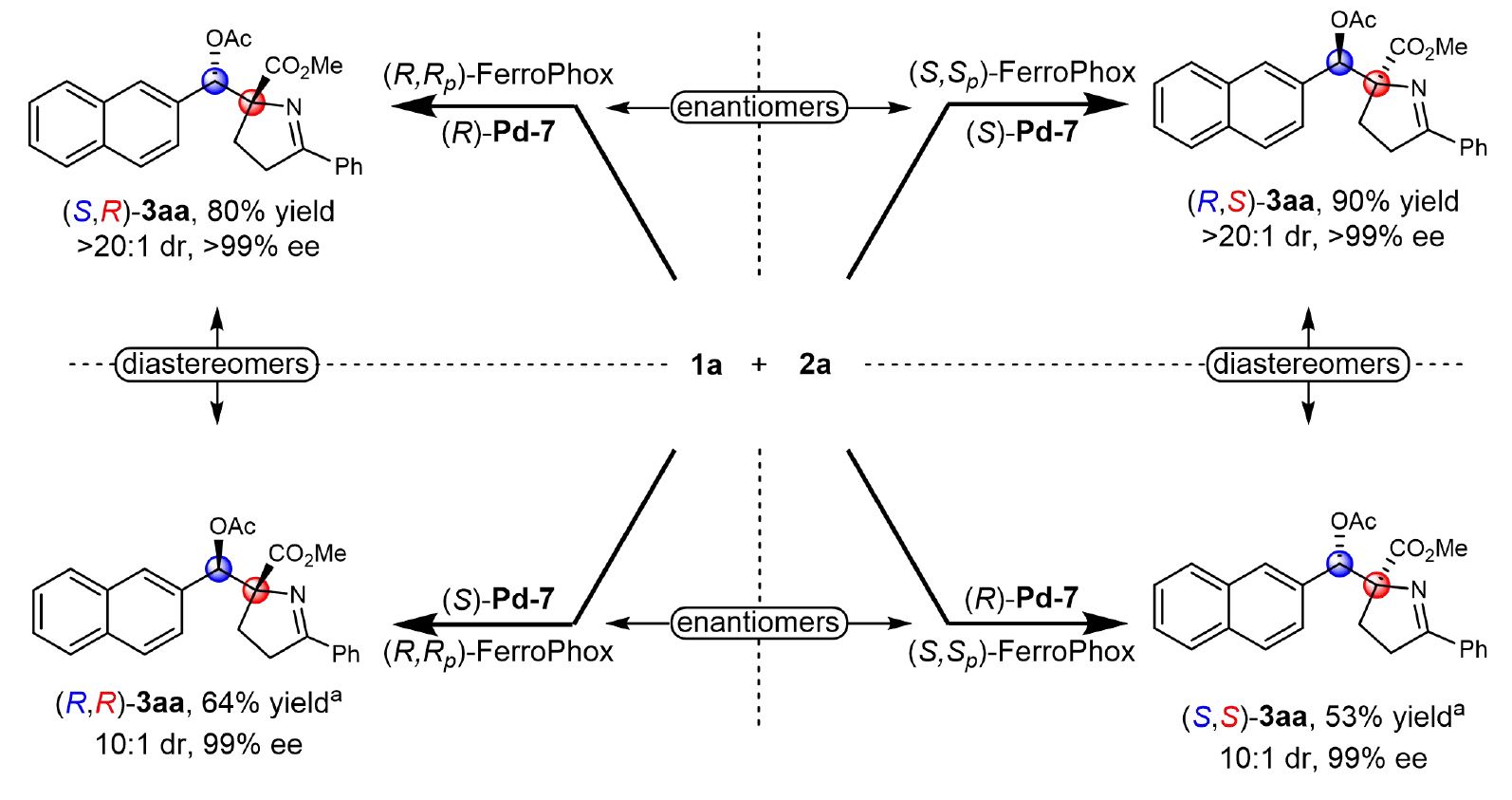
图23aa的立体发散合成
随后作者分别考察了苄基偕二醋酸酯(1)和亚胺酯(2)的底物适用范围(图3)。对于亲电试剂1,萘环6-位带有供电子或吸电子基团的底物均表现良好,以84-94%的产率,优异的非对映选择性和对映选择性(>20:1 dr, >99% ee)得到目标产物(3ab-3af)。杂芳基取代的底物(苯并呋喃、苯并噻吩、吲哚、喹啉、吲唑)3ag-3al同样适用(77-90%产率, >20:1 dr, 90->99% ee)。多环芳烃底物(1m, 1n)和含丙酰基的底物(1o)也能顺利反应,分别以76%,90%和83%的产率得到相应产物(3am, 3an, 3ao),且均保持高立体选择性(>20:1 dr, >99% ee)。萘-1-基取代底物(1p)反应活性较低,但仍能以37%产率、>20:1 dr 和 93% ee 得到产物(3ap)。然而,单环苯基底物(如苯基、对三氟甲基苯基)反应活性显著下降(23-32%产率),且产物为消旋体;含噻吩基或对苄氧基苯基的单环底物则未得到目标产物,这可能是由于此类单环底物较强的芳香性阻碍了钯催化的氧化加成过程。对于亲核试剂亚胺酯2,改变酯基或芳基取代基(邻、间、对位取代苯基,萘基,杂环)均能兼容,以良好至优异的产率(53-94%)和高立体选择性(>20:1 dr, >99% ee)得到相应产物(3ba-3ra)。此外,醛亚胺酯2s亦能有效参与反应,经N-脱保护及酰化,能以79%的收率,>20:1 dr和>99% ee获得β-氨基醇衍生物3sa。
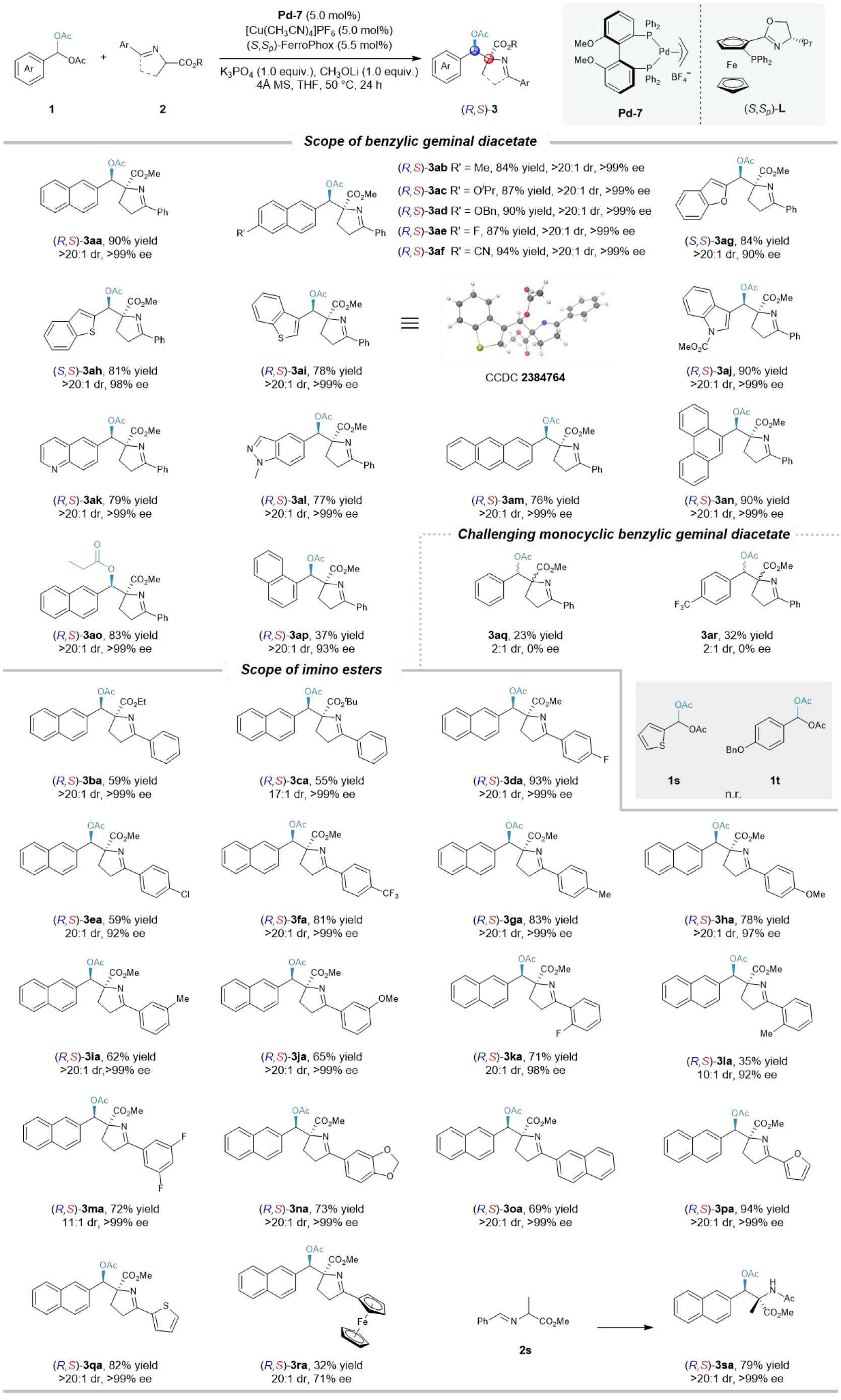
图3底物适用性研究
为深入探究该立体发散合成体系的底物适用性,作者使用(R)-Pd-7替代(S)-Pd-7,对部分底物进行了非对映发散性合成(图4)。结果表明,大多数底物在该体系下能以中等及以上的收率(47-83%)和优异的立体选择性(6:1-19:1 dr, >99% ee)给出对应的非对映异构体。
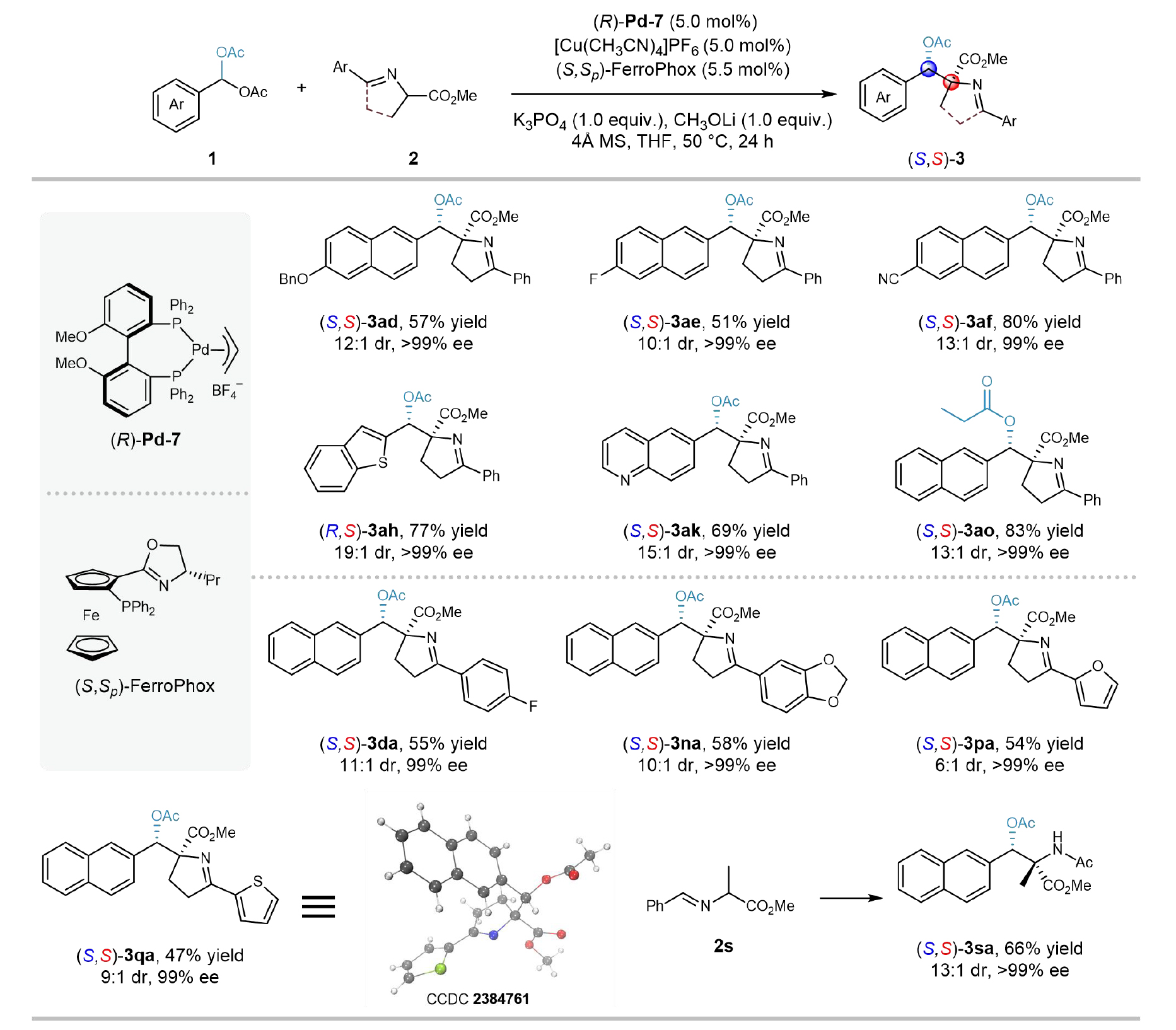
图4立体发散合成
为了进一步验证该反应体系的潜在应用价值,作者将其应用于多种药物及生物活性分子的后期官能团化,反应能以中等及以上的收率合成相应的手性苄醇衍生物(R,S)-3au-3az,并且普遍具有高非对映选择性(图5A)。此外,该反应体系展现出良好的可扩展性:将模板反应规模扩大40倍,成功实现了(R,S)-3aa的克级规模制备(1.14 g, 71%产率),且立体选择性未发生明显变化(>20:1 dr, >99% ee)。最后,作者对产物进行了一系列的转化,(R,S)-3aa能灵活转化为多种重要衍生物,包括脱保护得到的苄醇4a、还原得到的α,ω-二醇5a、还原胺化得到吡咯烷衍生物6a以及氧化得到的环氧化合物7a,充分证明其作为多功能合成砌块的潜力(图5B)。
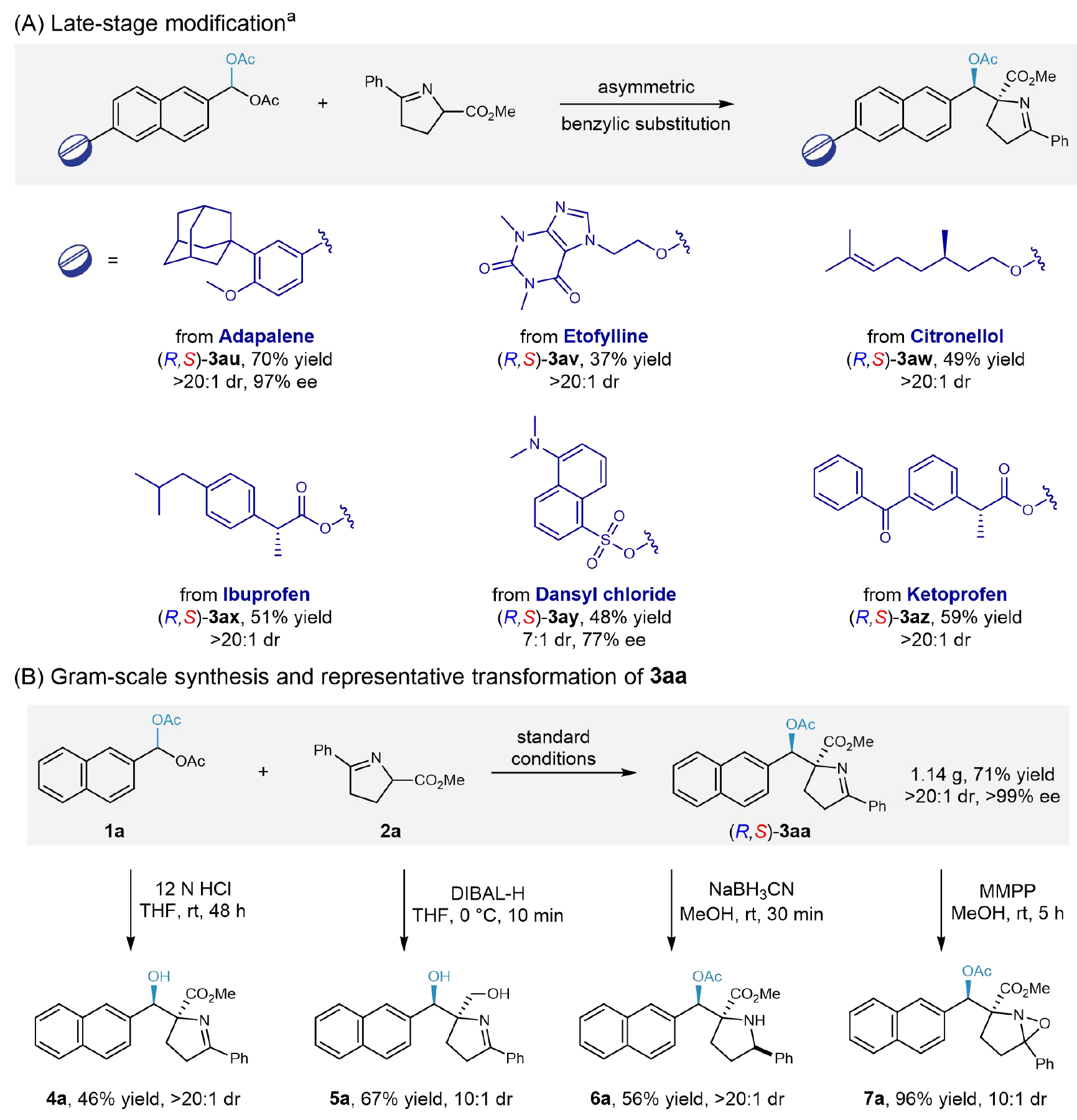
图5合成应用
作者通过密度泛函理论(DFT)计算揭示了反应机理及立体选择性的起源(图6):Pd⁰催化物种与苄基偕二乙酸酯1a经π-配位形成动态平衡的预配合物C1/C2,随后通过氧化加成过渡态TS1生成四个催化活性的η3-苄基-Pdᴵᴵ中间体(Int1-1~Int1-4)。尽管TS1-1与TS1-3之间存在11.1 kcal/mol的能垒差,暗示去对称化过程可能主导立体化学,但计算表明:构型相反的Int1-1和Int1-3可通过过渡态TSinter快速互变。该异构现象源于Pd⁰催化物种的亲核特性,其占据的d轨道可通过协同SN2型立体反转机制进攻亲电性的η3-苄基-Pdᴵᴵ中间体(图6B)。由于TSinter的吉布斯自由能显著低于亲核进攻能垒(16.7 kcal/molvs 19.4 kcal/mol),Int1-1与Int1-3在被亲核试剂捕获前已达平衡,排除了去对称化步骤的立体决定性。基于TSinter与亲核进攻步骤(TS2-1~TS2-4)的能量关系,该体系符合Curtin-Hammett原理,确认亲核进攻过程为反应的立体化学决定步骤。进攻Int1-1和Int1-3分别生成(R,S)-3aa和(S,S)-3aa,其过渡态能差(TS2-1与TS2-3,ΔΔG‡ = 5.6 kcal/mol)与实验结果吻合。此外,直接SN2路径(经TSNA生成η1-苄基-Pd)因能垒高达39.0 kcal/mol被排除,进一步佐证了氧化加成主路径的合理性。
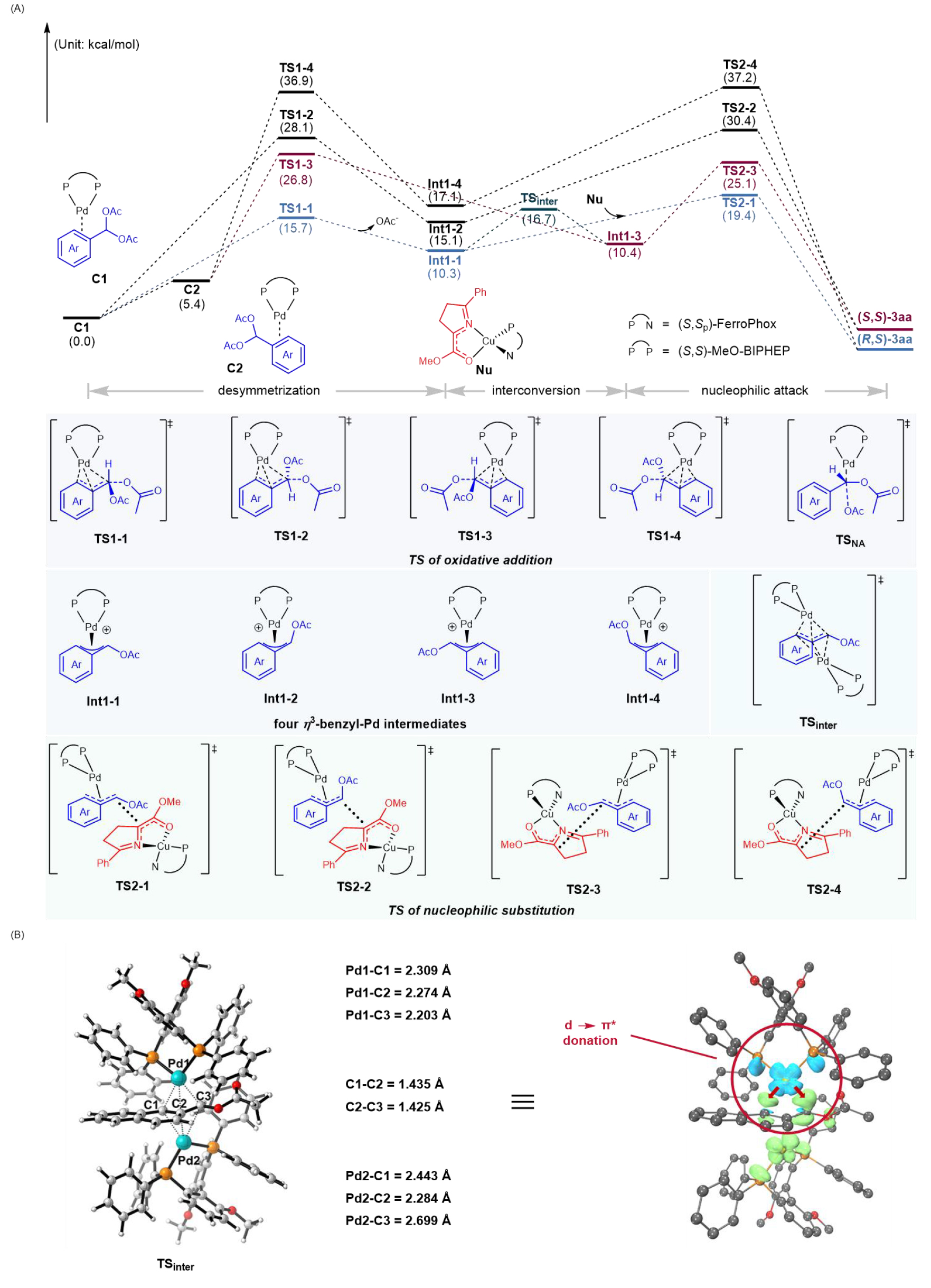
图6反应路径及Int1-1和Int1-3相互转化的密度泛函理论计算
最后,作者通过distortion/interaction models和IGMH分析揭示了过渡态TS2-1与TS2-3间的显著能量差异(19.4 kcal/molvs 25.1 kcal/mol)的本质原因:TS2-3中η3-苄基-Pd片段因萘环平面明显弯曲(破坏共轭效应)导致扭曲能显著升高(18.7 kcal/molvs 12.6 kcal/mol),而TS2-1的萘环构型相对平坦。尽管二者相互作用能接近(-47.1 kcal/molvs -48.0 kcal/mol),但能量分解显示TS2-1的静电作用(-44.2 kcal/mol)与诱导作用(-28.4 kcal/mol)更强,这主要是由于TS2-1中即将成键的两个碳原子距离更近(2.40 Åvs2.60 Å)。而TS2-3因η3-苄基-Pd中间体与亲核物种空间取向更匹配,导致Pd/Cu配体间范德华作用增强,色散能更低(-65.2 kcal/molvs -61.7 kcal/mol);此外TS2-1中更近的原子距离导致交换能升高。最终,TS2-1因扭曲能优势(差值6.1 kcal/mol)成为更稳定过渡态(ΔΔG‡ = 5.6 kcal/mol),与实验选择性一致。(图7)。
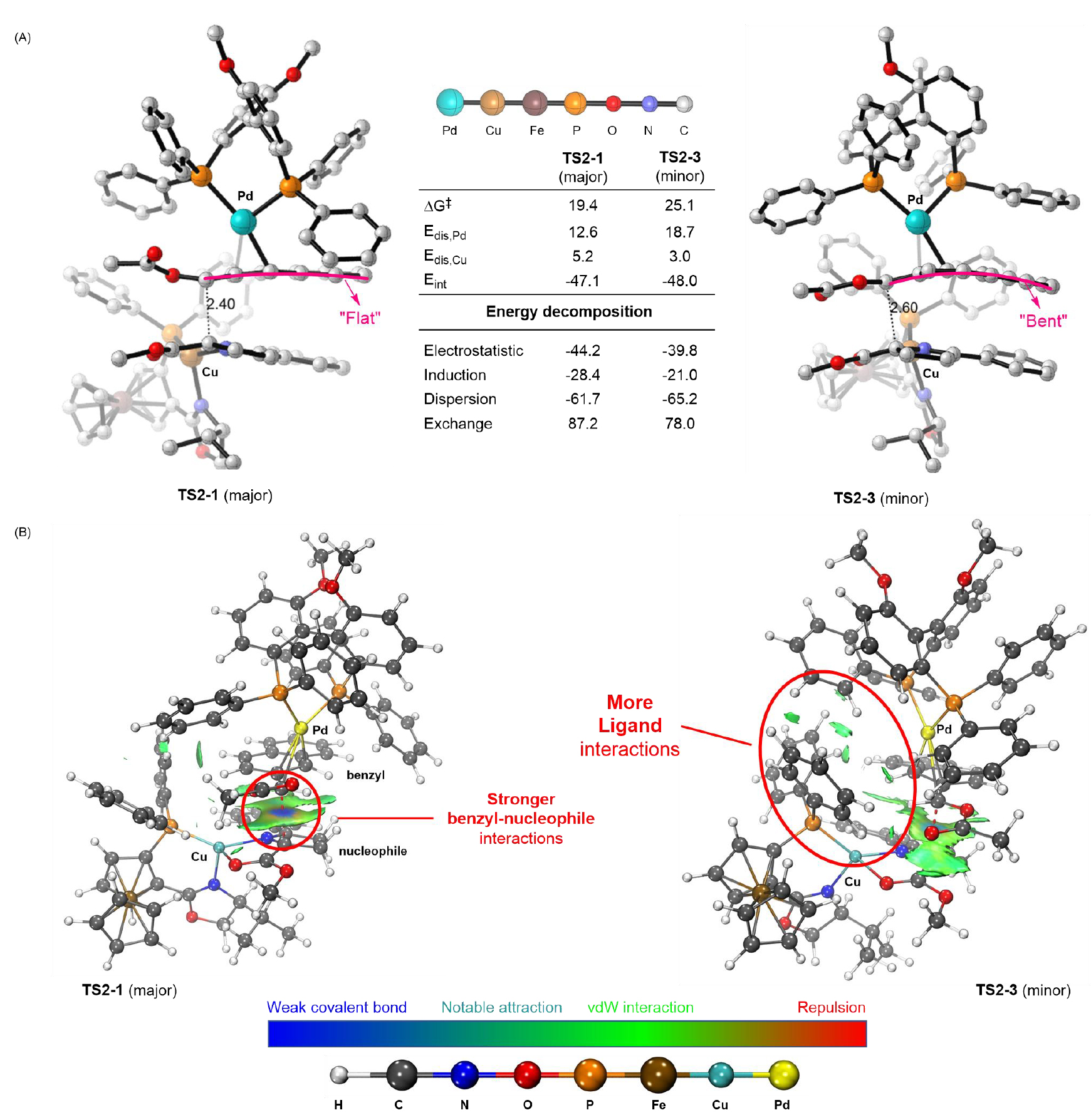
图7TS2-1和TS2-3的弱相互作用和能量分解分析
总结
综上,该工作成功开发了一种钯/铜双金属协同催化的不对称苄基取代反应,实现了含有两个相邻立体中心的手性苄醇衍生物的立体发散合成,揭示了双金属协同催化体系在立体化学控制方面的突出优势。
该成果近期发表于Nat. Commun.上,上海交通大学博士生韩冲宇为第一作者,上海交通大学张万斌教授和霍小红教授为共同通讯作者。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn