

过渡金属催化的烯烃二芳基化反应通过一步操作能同时在双键上引入两个芳基,从而可有效构建具有手性中心的复杂且有用的化合物,但通过添加两个芳基亲电试剂(ArX)而不需要预先制备的有机金属试剂的烯烃还原二芳基化反应还未得到开发(图1A)。另一方面,催化的不对称烯烃二芳基化反应也仅有少量报道(图1B)。
本文作者在过渡金属催化烯烃的不对称二碳官能团化反应中,最近发现了一种Ni催化的串联 Heck环化/Suzuki偶联反应,实现了烯烃的二芳基化,但这一串联反应的不对称版本一直没有尝试成功。受镍催化的不对称Heck环化反应的最新进展启发,作者决定利用镍催化剂的易氧化加成和易得到多种氧化态的能力,通过对映选择性Heck环化/捕获原位生成的σ-烷基Ni(Ⅱ)物种,来实现镍催化的烯烃对映选择性还原二芳基化反应。
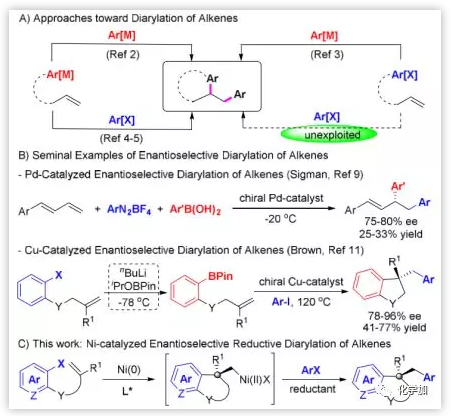
图1. 过渡金属催化的烯烃对映选择性二芳基化反应
(图片来源:J. Am. Chem. Soc.)
作者以N-(2-溴苯基)N-甲基甲基丙烯酰胺1a和溴苯2a的反应为模板反应,对反应条件进行了探索。在Ni(COD)2(10 mol%)、L1(20 mol%)、B2Pin2(2 Eq.)、ZnO(2 Eq.)、K3PO4(2 Eq.)作碱,DMA为溶剂的条件下,以83%的收率得到目标产物氧化吲哚3aa(图2,entry 1)。对手性配体L2-L11进行全面考察(entry 7-15),表明PHOX-型配体L11在立体选择性方面最为有效(91% ee,entry 15),L11的二茂铁骨架对该反应的选择性至关重要。碘源可提高交叉亲电偶联反应的活性,KI的加入使3aa的收率提高到63%,而不影响对映选择性(entry 16)。一系列的控制实验表明,在没有Ni0催化剂、Zn0或配体(entry 18-20)的情况下,未形成产物。在不含B2Pin2的条件下,产率也下降至28%,但保留了对映选择性(entry 21和17)。
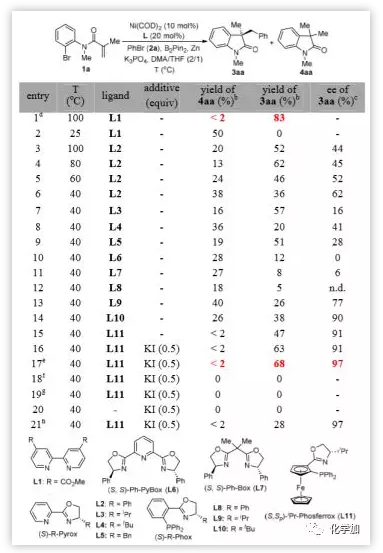
图2. 反应条件的优化
(图片来源:J. Am. Chem. Soc.)
有了最佳反应条件,作者考察了芳基溴代物2的适用范围。令人高兴的是,各种芳基溴代物都能经过环化交叉偶联得到目标产物,且具有优良的对映选择性(图3)。烷氧基、氨基、氟和缩酮等官能团具有良好的耐受性(3ab-3aj)。值得注意的是,氰基在以前的方法中是有问题的,能在该反应中兼容 (3ag)。X射线晶体分析确定了3al的绝对构型为3R,并对所有其它产物的绝对构型也进行了相应的确认。硼酸盐官能团化的芳基溴以60%的收率和90% 的ee顺利得到3am,为进一步官能团化提供了机会。为了进一步证明该方法的通用性,作者研究了多个杂环的还原交叉偶联反应。苯并二氧嘧啶(3an)、吡啶(3bo)、二苯并呋喃(3ap)、二苯并噻吩(3bq)、吲哚(3ar)和苯并呋喃(3bs)等都可以有效地转化成相应的产物,且具有良好的产率和优秀的对映选择性。苯丙氨酸衍生物的交叉偶联提供了所需的产物(3bt),而不影响手性中心。不同取代芳基溴代物的ee值无明显差异,表明反应的对映选择性决定步骤是迁移插入。
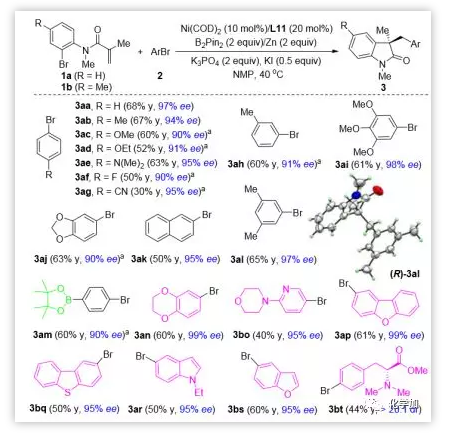
图3. 芳基溴代物底物的扩展
(图片来源:J. Am. Chem. Soc.)
接下来作者考察了关于烯烃连接的芳基溴代物1的底物范围(图4)。首先研究了苯胺部分的苯环上的取代模式。对-,间-和邻-甲基和对-氟苯胺底物都能以高对映选择性转化成相应产物3ba-3ea。值得注意的是,官能团Cl和OMe也能兼容,可用于进一步的转化(3fa-3ga)。更重要的是,该反应能成功地应用于氮杂氧化吲哚3ha的合成,产率为50%,ee为94%,这在天然产物和药物发现种具有重要意义。作者还研究了丙烯酰胺双键的Cα取代基(R3)对反应结果的影响。苄基、正己基、异丙基和甲氧甲基取代基都能兼容,得到相应的氧化吲哚3ib-3kb和3li,产率良好,对映选择性优良。 N-苄基乙酰苯胺1m的环化交叉偶联反应也能顺利地进行,得到3mi,由于N-苄基易除去,因此它是合成氮上去保护的氧化吲哚的有效途径。
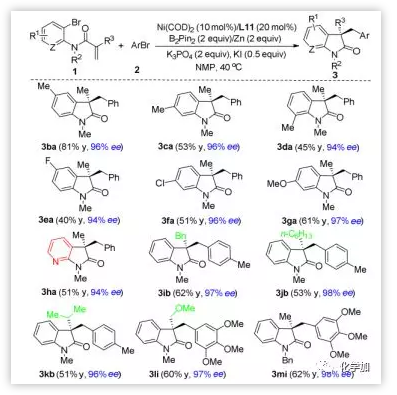
图4. 烯烃底物的扩展
(图片来源:J. Am. Chem. Soc.)
虽然对映体富集的二氢吲哚5aa不能通过2-溴-N-甲基-N-(2-甲基烯丙基)苯胺与2a的环化交叉偶联直接合成,但用LiAlH4还原(R)-3aa能够有效获得对映体富集的吲哚啉5aa,并能取得优异的产率,同时保持对映体纯度。(R)-3aa的区域选择性溴化能以94%的收率和90%的ee得到3na,能进一步官能团化(图5)。
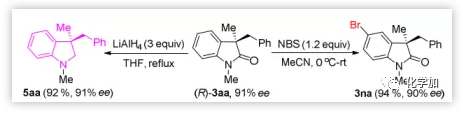
图5. 合成对映体富集的氧化吲哚
(图片来源:J. Am. Chem. Soc.)
为了研究反应机理,作者设计了一系列控制实验。将PhZnBr投入到优化的反应条件中,没有3aa生成。没有镍的条件下(图2,entry 18)没有消耗原料,这表明锌不可能直接插入芳基溴中。使用有机还原剂TDAE(四(二甲基氨基)乙烯)代替Zn0能以显著的收率得到3aa。在不存在B2Pin2的情况下,也能观察到3aa,证明催化途径可以在不存在任何硼中间体的情况下进行。为了进一步理解芳基硼酸盐在催化循环中的作用,在该交叉偶联反应中加入PhBPin,未检测到3aa,表明B2Pin2可能充当了还原剂的角色。
室温下1a通过氧化加成和随后的迁移插入能形成σ-烷基-Ni(Ⅱ)配合物6,同时,室温下反应能以50%的产率得到4aa且未检出3aa, 这表明环化过程并不是催化循环的决速步。当配合物6以化学计量比的方式使用时,在没有Ni0催化剂的情况下,产物3aa的收率为35%,4aa的收率为34%(Eq 5),从而支持了σ-烷基-Ni(II) 6作为催化循环关键中间体的机理。由于Ni(0)与芳基卤化物的氧化加成是可逆的,作者认为迁移插入过程(对映选择性决速步)应该是不可逆的。最后,合成2-甲苯基-Ni(II)络合物7,并将其投入反应条件(不含Zn0),以20%的产率得到3au。Ni(II)络合物6与7反应能以25%的产率形成3au,这表明不能排除转金属化的机理。
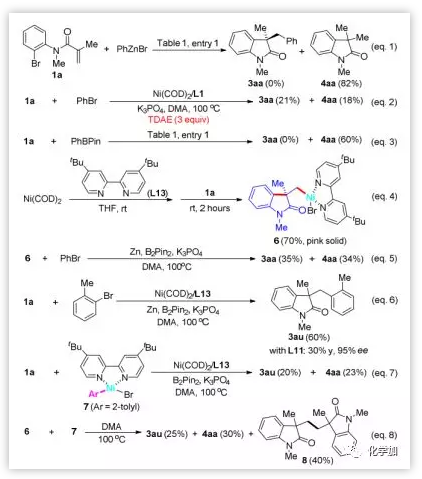
图6. 机理研究
(图片来源:J. Am. Chem. Soc.)
基于上述结果和先前对交叉亲电偶联的研究,作者提出了如图7所示的机理,其中包括了两个可能反应途径。芳基溴代物1氧化加成到Ni(0)物质上,然后进行分子内碳镍化,产生σ-烷基-Ni(II)X物质A,被化学计量的Zn/Pin2B2还原,所得的σ-烷基-Ni(I)中间体B与芳基溴2第二次氧化加成形成σ-烷基-Ni(III)ArX物质C,还原消除再生Ni(0)催化剂的同时得到所需产物3(图7,途径A)。另一种合理的Ni(0)/ Ni(II)催化循环,涉及Ni(II)中心A和D之间的金属转移,形成σ-烷基-Ni(II)ArX物种E,还原消除得到产物3(图7,途径B)。
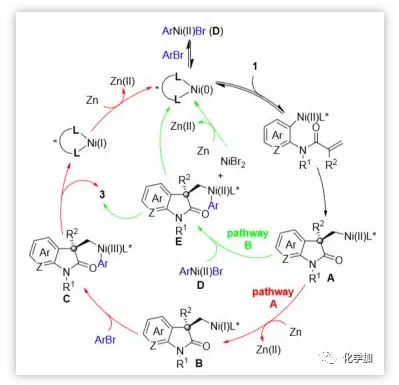
图7. 可能的反应机理
(图片来源:J. Am. Chem. Soc.)
小结:孔望清教授课题组发展了一种机理上全新的烯烃二芳基化方法,镍催化条件下两个不同的芳基溴通过串联Heck环化/还原交叉偶联反应实现了烯烃的对映选择性二芳基化。该反应条件温和,具有良好的官能团耐受性,产率良好,且具有优良的对映选择性,可构建各种含有全碳季碳中心的双杂环,在活性分子及药物改造中具有潜在的应用价值。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn