

泽布替尼诞生于北京昌平的百济神州研发中心,2012年7月百济神州研究团队正式对BTK开发项目立项,经过一系列筛选与测试后最终在500多个化合物中,选定了最终候选分子编号BGB-3111,意为百济神州成立后做出的第3111个化合物。

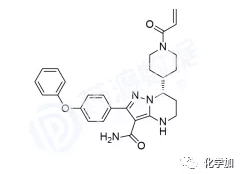
BRUKINSA是一款由百济神州科学家自主开发的布鲁顿氏酪氨酸激酶(BTK)小分子抑制剂(更多阅读:抗癌靶点BTK及其抑制剂的研发进展),目前正在全球进行广泛的关键性临床试验项目,作为单药和与其他疗法进行联合用药治疗多种B细胞恶性肿瘤。BRUKINSA于11月14日获得美国食品药品监督管理局(FDA)批准用于治疗既往接受过至少一项疗法的套细胞淋巴瘤(MCL)患者。
淋巴瘤是一组起源于B、T或NK细胞的含多种亚型的恶性肿瘤。套细胞淋巴瘤(MCL)通常是侵袭性的非霍奇金淋巴瘤(NHL),起源于“套区”的B细胞 [ii]。2019年,在美国预计约有74,200新增NHL病例,其中MCL新增病例为总数的6%(约4,452起)。套细胞淋巴瘤通常预后很差,中位生存期为三至四年 。套细胞淋巴瘤在诊断时通常已经处于疾病晚期。
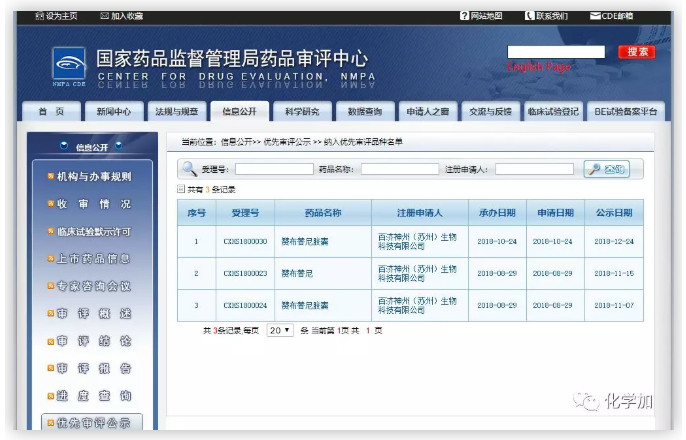
BRUKINSA用于治疗复发/难治性(R/R)MCL患者和R/R慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者的两项新药上市申请(NDA)已被中国国家药品监督管理局(NMPA)纳入优先审评,正在审批过程中。
BRUKINSA在美国以外国家地区尚未获批。
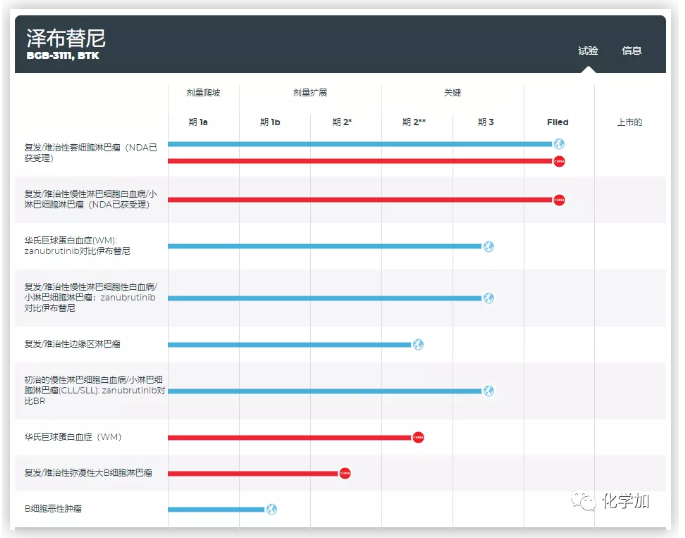
BRUKINSA获得FDA批准是基于两项临床试验的有效性数据,数据显示BRUKINSA在参与两项临床试验的患者中均产生高达84%的总缓解率(完全缓解和部分缓解综合;ORR)。在泽布替尼用于治疗复发/难治性(R/R)MCL患者的多中心的2期临床试验BGB-3111-206(clinicaltrials.gov登记号: NCT03206970)中,ORR为84%(95%置信区间:74%, 91%),包括59%的完全缓解(FDG-PET扫描在此项试验中为必须)以及24%的部分缓解。此项试验的中位持续缓解时间(DOR)为19.5个月(95%CI: 16.6, NE),中位随访时间为18.4个月。在全球1/2期临床试验BGB-3111-AU-003(clinicaltrials.gov登记号: NCT02343120)中,ORR为84%(95%置信区间:67%, 95%),包括22%的完全缓解(FDG-PET扫描在此项试验中并非必须)以及62%的部分缓解。此项试验的中位DOR为18.5个月(95% CI:12.6, NE),中位随访时间为18.8个月。 百济神州创始人、首席执行官兼董事长欧雷强先生表示:“我们致力于改善全球癌症患者的治疗,此次获批使我们更接近实现为全球患者带来最高质量药物的使命。紧接先前在这项适应症上获得的突破性疗法认定,今天BRUKINSA获得FDA上市批准更是证明了其作为一项针对复发或难治性MCL治疗方案的重要性。我们将继续在其他血液肿瘤中对BRUKINSA进行开发,也希望此次获批是为后续的众多上市批准首开先河。” 百济神州高级副总裁、全球药政事务负责人闫小军女士评论道:“BRUKINSA作为一款BTK抑制剂,设计旨在最大化靶向占有率,同时避免脱靶效应。BRUKINSA自2014年开启广泛的临床项目以来,已入组1600多位患者。今天获得加速批准是百济神州团队以及临床试验研究者们多年来付出的结果,但更重要的是要感谢参与临床试验的每位患者。我们很荣幸能有机会参与开发这款疗法,使其成为百济神州自主研发并被FDA批准的首款抗癌药物。” 中国北京大学肿瘤医院大内科主任、淋巴瘤科主任、医学博士朱军教授表示:“作为一名中国肿瘤临床医生,能够见证由本土生物医药公司自主研发的创新抗癌药首次获得FDA批准的历史突破,我感到非常激动。这一突破是我国本土生物医药行业和临床肿瘤研究的一个重要里程碑,标志着我们不仅能为中国患者研发新药,也能让更多国家的患者受益其中,为世界提供中国的方案,贡献中国的智慧。” 美国淋巴瘤研究基金会首席执行官Meghan Gutierrez评论道:“泽布替尼作为一项治疗MCL的二线疗法获批是在该适应症治疗方案上的重大进步。治疗选择的拓宽能够帮助提高患者体验,并为确诊为MCL的患者带来希望。”
来源 | 界面新闻、百济神州、新京报
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn