

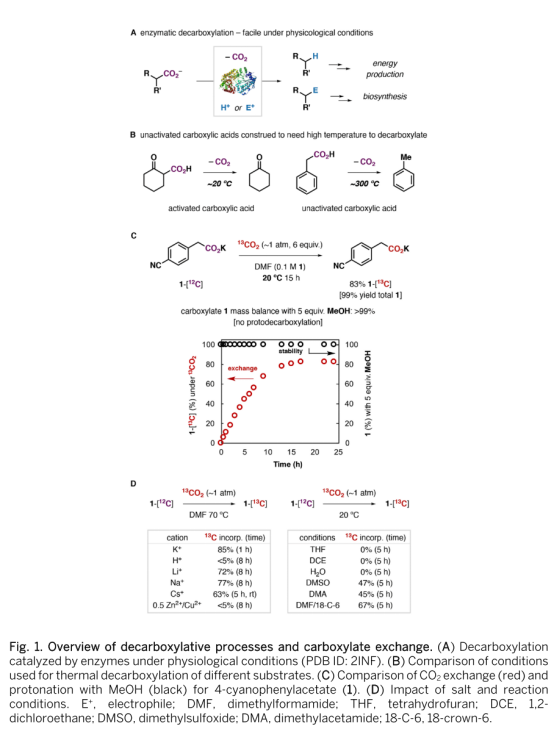
脱羧反应是生物过程与有机转化中的基础反应,发酵、呼吸及多种次级代谢产物的生物合成中都包含了脱羧(Fig. 1A)。其中,脱羧酶能够稳定脱羧中的碳负离子中间体并加速CO2逸出。而在有机转化中,不含稳定碳负离子基团的羧酸的脱羧是热力学过程。因此,未活化羧酸的脱羧需要高温、氧化剂或对羧基进行预活化(Fig. 1B)。羧基化是脱羧的微观逆反应,但在生化过程中促进CO2固定过程的酶与促进脱羧过程的酶具有不同作用。而有机转化中,羧基化通常需要使用强亲核性的有机金属试剂。羧酸的脱羧/羧基化反应长久以来被人们忽视,在为数不多的实例中,反应具有高度的底物依赖性,且需要极高温度。最近,加拿大阿尔伯塔大学的Rylan J. Lundgren教授发现,在大气压力下13CO2存在下,羧酸能够在DMF中发生羧基交换反应生成同位素标记的羧酸,通过机理研究,作者发现反应经历了碳负离子过程,相关成果发表在Science(DOI: 10.1126/science.abb4129)上。
首先,作者尝试了对氰基苯乙酸盐1的反应(Fig. 1C),于20 oC下,在0.1 M的DMF溶液中,1与6当量的13CO2反应能够以定量的收率及83%的同位素丰度回收同位素标记的1。加入弱酸甲醇并未得到脱羧质子化产物,证明碳负离子被溶解在DMF中的13CO2捕获是有利的。作者随后对该反应的条件进行了进一步优化(Fig. 1D)。羧酸根的抗衡阳离子对反应具有重要影响,羧基即使在高温下也无法发生脱羧,Li盐、Na盐会导致反应速度变慢,而Cs盐可以加快反应速率,加入二价金属时无反应发生。极性溶剂对反应也是必要的,反应在DMSO、DMF以及DMA中可以顺利发生而以DCE、THF或水作溶剂时,仅能回收反应原料。加入相转移催化剂18-冠-6可以显著提升反应效率。
(图片来源:Science)
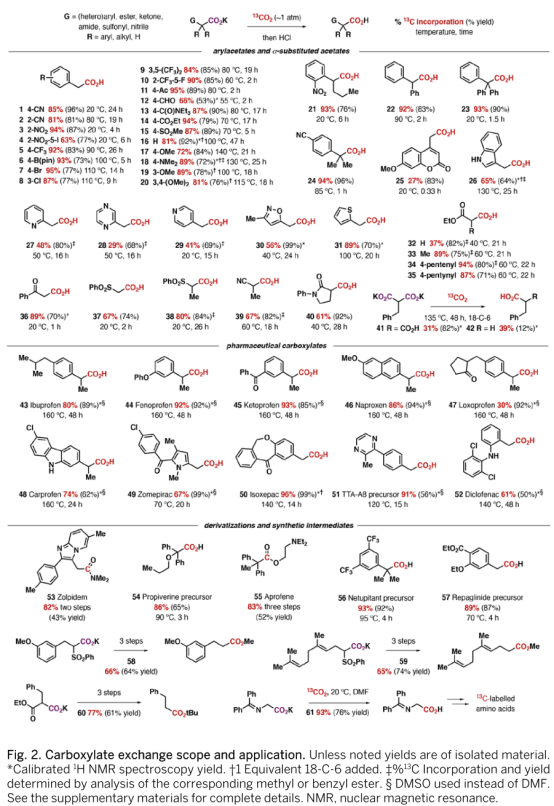
作者随后对反应进行了底物扩展(Fig. 2)。结果表明,该羧基交换反应具有优秀的官能团耐受性和底物适用性,包括多种合成砌块、药物实体和氨基酸衍生物均可顺利发生转化得到一系列具有重要意义的同位素标记的羧酸化合物,当以50当量的13CO2作为同位素试剂,产物均能得到大于95%的同位素丰度。值得一提的是,该反应可用于制备标记的非甾体抗炎药(ADMEs),而以往合成此类化合物需要利用过渡金属催化,引入标记的氰基后水解或以13CO作为同位素试剂。当底物为含给电子基团的芳香乙酸时,反应通常需要较高温度(100-130 oC)且需要加入18-冠-6促进反应进行。实用的有机合成子,包括丙二酸单酯(32-35)、酮酸(36)、β-磺酰基羧酸(37,38)等结构均可发生反应。此外,更重要的是,该反应可用于制备包括羧酸衍生物在内的一系列药物及其中间体,药物分子中的酯基或酰胺可以通过羧基的转化(唑吡坦53,普洛芬55)或报道的方法方便得到。与推测的碳负离子历程相符,光学纯的萘普生46反应后产物发生了消旋。虽然简单羧酸无法发生该转化,但其依然可以通过β-磺酰基羧酸的羧基交换/脱磺酰基反应或丙二酸单酯的羧基交换/脱羧过程得到。甘氨酸衍生物61的制备为合成其他标记的氨基酸提供了良好的合成起点。
(图片来源:Science)
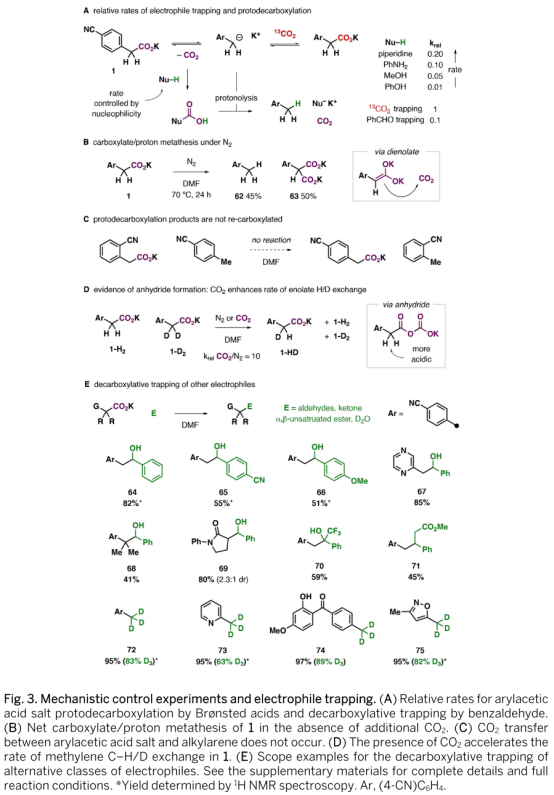
作者随后对反应机理进行了研究(Fig 3)。首先,反应历程可能包含了碳负离子中间体,该中间体可能产生自直接脱羧或烯醇负离子。反应所需的温度仅与底物稳定碳负离子的能力有关而与其氧化电势无关。加入自由基清除剂并不影响反应效率,因此排除了自由基历程。底物中的碳负离子发生羧基交换而未被其他亲电试剂淬灭可能是由于CO2在DMF中具有良好的溶解性及其自DMF中逸出的不利动力学效应。作者发现,0.25 M的13CO2的DMF溶液在氮气氛围下保持一天仍能保持0.2 M的浓度。而碳负离子与13CO2的反应速率大约为其与苯甲醛反应速率的10倍。令人惊讶的是,在此条件下,该碳负离子的脱羧质子化反应速率与质子源羧酸的酸性成反比,这可能是由于这些物种会竞争性地与脱羧释放的12CO2结合从而抑制其发生逆反应。在无外加CO2的条件下,1缓慢反应,最终近乎等量地生成脱羧质子化产物62及丙二酸63,62来源于碳负离子攫取第二分子羧基上的氢,而63来源于碳负离子对第二分子脱羧后生成CO2的进攻(Fig. 3B)。脱羧质子化生成的产物在其他分子发生脱羧的条件下并不会进一步逆转为羧酸(Fig. 3C)。根据1-HD的生成,反应过程中可能生成了酸酐中间体,该中间体具有更高的活性(Fig. 3D),但作者并未检测到该中间体,无法发生烯醇化的羧酸23或24能够发生反应表明该酸酐中间体并不是必须的。
最后,在理解反应过程后,作者尝试加入不同亲电试剂以捕获脱羧生成的碳负离子以实现反应的多样性转化(Fig. 3E)。通过加入醛、三氟甲基酮或Micheal受体,作者实现了多种碳碳键的生成,反应速率与反应物的亲电性有关。加入18-冠-6在某些情况下可以促进反应进行。而以重水为亲电试剂可以合成具有重要意义的氘代甲苯类化合物。
(图片来源:Science)
总结
加拿大阿尔伯塔大学的Rylan J. Lundgren教授发展了一种在DMF中非催化的羧酸可逆脱羧/羧基化反应,该反应不仅可用于同位素标记的药物实体及其合成中间体的合成,更可通过加入其他碳亲电试剂以实现碳碳键的生成。通过多种实验及理性分析,作者确定了反应历程中包含了碳负离子中间体。在设计同位素标记药物的合成路线以及开发新型的脱羧反应中,该可逆脱羧反应将具有更广泛的运用。
撰稿人:H.D.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn