

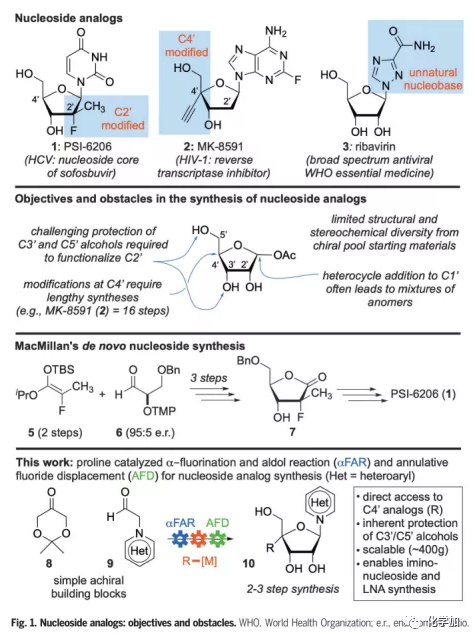
核苷作为生物大分子核酸的单体,在生物体内参与多种生物过程。核苷类似物(NAs)是天然核苷的模拟物,已被广泛用作化学生物学工具,且作为抗肿瘤药物和小分子抗病毒药物用于多种疾病治疗。因此,快速获得结构多样化的核苷将有利于新型抗肿瘤及抗病毒药物的开发。通常,对核苷的改造包括糖环(尤其是2′-和4′-位)的修饰以及碱基的替换,此外,较天然的D-型核苷而言,L-型核苷具有更强的代谢稳定性,已被用于艾滋病的治疗。但是,合成不同的NA需要使用不同的起始原料,且NA的手性高度依赖糖的手性池。此外,合成非天然核苷的步骤通常十分繁琐,例如,合成具有抗HIV-1活性的MK-8591需要16步。因此,亟需开发一种简洁、通用、高效的NA合成方法以促进相关学科的研究。最近,加拿大西蒙弗雷泽大学的Robert Britton教授开发了一条NA的新型合成路线,从非手性的原料出发,使用廉价的脯氨酸作为催化剂,仅需数步即可实现多种NA的百克规模合成(Fig.1),兼具创新性和实用性。相关成果发表在Science(DOI: 10.1126/science.abb3231)上。
(图片来源:Science)
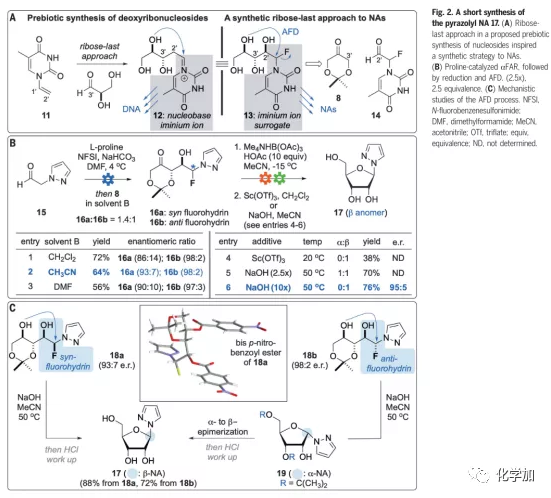
在推测的生物合成途径中,核苷的核糖母环是由碱基烯胺与甘油醛的缩合反应生成的,据此作者设计了含不稳定N,F-缩醛结构的13作为生源合成途径中间体的等价物,13可以通过分子内氟取代环化反应环合生成核苷,而13可以通过立体选择性的交叉Aldol反应由酮8和醛14得到(Fig.2a)。为了验证想法,作者首先尝试了DMF中α-吡唑醛15的氟化反应,在脯氨酸和NFSI的作用下,反应生成了单一产物氟代醛,随后向其中加入酮8的乙腈溶液即可以1.4:1的dr值得到化合物16a和16b(Fig.2b)。这两个化合物无法相互转化,表明α-吡唑-α-氟化醛无法进行动力学拆分,或脯氨酸催化缩合反应时生成两种构型时的过渡态能量类似。随后,经过羰基还原以及酸性或碱性条件下的环化反应即可得到β-核苷,值得一提的是,在碱性条件下的环化反应中,碱的量对产物的构型有重要影响,加入10当量氢氧化钠时,产物为单一构型。为了验证环化的机理,作者在羰基还原后分离了两种异构体并分别对其进行了环化反应(Fig.2c)。作者发现syn-和anti-构型的底物在碱性条件下会分别生成β-和α-构型的核苷,但在该反应条件下α-构型核苷会异构化为更稳定的β-产物。
(图片来源:Science)
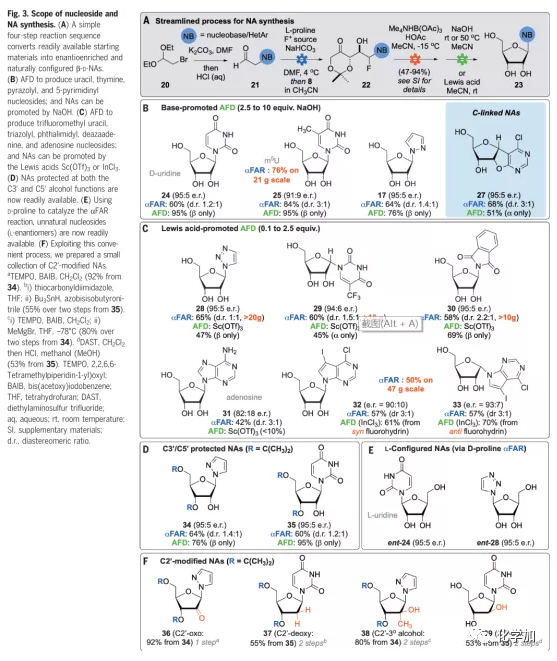
为验证反应的通用性,作者合成了一系列α-杂环醛以合成NAs(Fig.3),以NFSI或Selectfluor为氟源,经一锅法氟化-Aldol反应后,作者得到多种砌块并对其进行酸性或碱性条件下的氟取代环化反应。该过程中,多种核苷碱基,包括尿嘧啶、胸腺嘧啶、三唑、吡唑、腺嘌呤、2,6-二氯嘌呤都对反应兼容。通常,最优的Lewis酸是三氟甲磺酸钪或三氯化铟。吡唑和尿嘧啶核苷的合成需要在碱性条件下进行。核苷28、29、32、33的光学纯度与其环化前的前体光学纯度相似。三氟甲基尿嘧啶29和氯碘嘌呤32-33的环化是在酸性条件下进行的,然而,只有anti-构型的底物发生环化生成29且产物不会发生异构化,而syn-和anti-的底物均会环化生成32和33。值得一提的是,该反应可以以大于10 g规模合成多种核苷并适用于非天然L-核苷的合成。此外,反应产物不经酸性水溶液后处理时可以得到3′-,5′-位保护的核苷,为其2′-位进一步衍生化提供了机会,作者因此合成了一系列2′-修饰核苷。
(图片来源:Science)
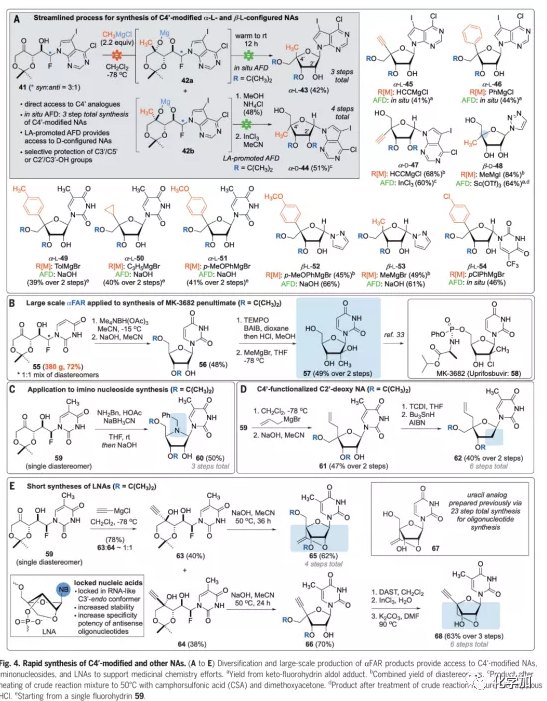
利用有机金属试剂对41的羰基在-78 oC下进行加成后再进行环化可以生成4′-取代核苷(Fig.4A),二氯甲烷是最优的溶剂,产物以Re-面加成产物为主,其中,42a在加热至室温后自发环化生成β-产物,而42b在氯化铵水溶液淬灭后在三氯化铟促进下可以发生环化生成α-核苷。多种有机金属试剂适用于该反应,目前,加成反应的立体选择性主要是底物控制的,但其也为核苷的快速衍生化提供了机会。值得一提的是,在酸性条件下,环化反应有时会生成保护基迁移的产物。在此基础上,为了验证该过程的实用性,作者进行了HCV NS5B抑制剂MK-3682前体的数百克规模合成,以500 g尿嘧啶为原料,作者得到了380 g底物55并以优异的收率完成环化。此外,作者分别通过还原胺化处理底物59中的羰基和对61中2′-位羟基经Barton-McCombie脱氧反应脱氧得到了氨基核苷60和2′-脱氧核苷62,进一步证明了该方法的灵活性。
最后,作者进行了锁核酸(LNA)的合成,该类化合物2′-位与5′-位的醚键进一步增加了底物的代谢稳定性。通过对格氏试剂的量进行简单优化,作者以接近1:1的dr值得到了63与64,其中,63在碱性条件下发生环化,仅以4步合成了此前需23步合成的LNA骨架;而64也经三步反应生成具有炔基的LNA骨架,其中炔基可进一步通过Click反应或Sonogashira反应进行衍生化。
(图片来源:Science)
总结:核苷类似物库是药物化学和化学生物学研究的有力武器,加拿大西蒙弗雷泽大学的Robert Britton教授开发的核苷类似物的快速合成方法仅使用廉价易得的非手性原料和脯氨酸催化剂,数百克的制备规模证明了该方法能够用于工业生产,灵活的使用方式使结构多样化的核苷类似物的快速制备成为可能。该方法定将会在核苷的化学合成中占据一席之地,极大地促进核酸的化学生物学和药物化学研究。
撰稿人:H.D.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn