


最近,四川大学刘波教授课题组取得新突破,以发散式策略完成了8个乌药烷倍半萜二聚体天然产物的全合成研究(图1,Nat. Commun. 2019, 10, 1892),该工作一经发表即被Nat. Commun.选为亮点工作,这是该课题组对于乌药烷倍半萜二聚体的第二代合成。
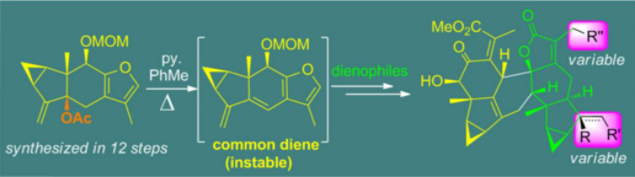
图1 乌药烷倍半萜的发散式全合成
刘波教授课题组简介
刘波教授课题组研究兴趣主要以萜类为主的多环复杂天然产物为合成目标,借助仿生合成策略,注重结合串联反应和一锅多组分反应,开展目标分子的高效全合成和相关合成方法学研究工作。承担了国家自然科学基金(重点项目、面上项目、优秀青年基金)、科技部“973”计划、教育部新世纪优秀人才支持计划等多个项目的研究工作。
刘波教授简介

刘波,四川大学化学学院教授,国家优秀青年基金获得者。1998年毕业于西南师范大学,获理学学士学位。2001年在中科院成都有机化学研究所获理学硕士学位,师从冯小明研究员与蒋耀忠研究员。2004年于中科院上海有机化学研究所获理学博士学位,师从周维善研究员。2004年9月-2007年3月,在美国德克萨斯大学西南医学中心从事博士后研究,主要从事过渡金属催化的反应研究及天然产物全合成,导师为Prof. Jef K. De Brabander。2007年6月至今,就职于四川大学化学学院。
刘波教授在J. Am. Chem. Soc., Angew. Chem. Int. Ed., Org. Lett., Chem. Commun., Eur. J. Chem.等专业期刊上发表SCI论文60多篇。一些研究成果被评选为Org. Lett.和J. Am. Chem. Soc.的most read articles,被收录进入化学专业网站Organic Chemistry Highlights,被化学博客brsmbog. com和chemblogs. net以及专业评述性杂志Synfacts收录和正面评价。刘波教授获得主要奖项包括:教育部新世纪优秀人才支持计划(2009)、国家自然科学基金委优秀青年基金(2013)、Thieme Chemistry Journal Award(2014)、ACP Lectureship Awards to Japan & Malaysia(2014)、ACP Lectureship Awards to Taiwan(2015)、中国化学会维善天然产物合成奖(2015)、ACP Lectureship Awards to Singapore(2016)等。
前沿科研成果
乌药烷倍半萜二聚体天然产物的发散式全合成
刘波教授课题组对乌药烷倍半萜类天然产物的合成研究始于2008年(图2),在开始的几年集中于乌药烷倍半萜单体的合成研究,之后转向[4+2]型二聚体的全合成研究,经过多年努力,取得了一系列成果:(1)2011年,实现了乌药烷倍半萜单体的合成(Org. Lett. 2011, 13, 5406);(2)2013年,利用仿生模拟的途径首次完成乌药烷二倍半萜天然产物bolivianine和isobilivinine的高效全合成(J. Am. Chem. Soc. 2013, 135, 9291; Chem. Eur. J. 2014, 20, 2613; CCL 2017, 28, 113);(3)2015年,发展了一种铑催化分子内环丙烷化反应构建了乌药烷3/5/6并环骨架,为快速合成这类天然产物打下良好基础(CC 2015, 51, 6179);(4)2017年,首次实现乌药烷倍半萜二聚体天然产物shizukol D和sarglabolide J全合成(Angew. Chem. Int. Ed., 2017, 56, 637);(5)今年进一步在17年工作的基础之上,实现了乌药烷倍半萜二聚体的发散式全合成(Nat. Commun., 2019, 10, 1892)。、
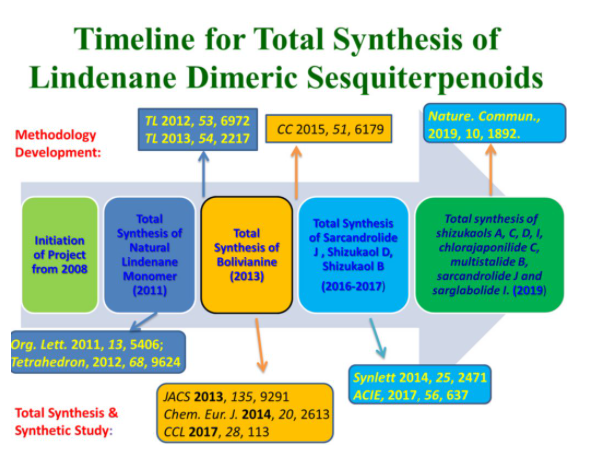
图2 刘波教授课题组乌药烷天然产物单体及其二聚体的合成研究进程
其中,对于[4+2]型乌药烷倍半萜二聚体,可以根据B环上取代基的不同,分为type 1、type 2和type 3型(如图3所示)。其中刘波教授课题组完成了type 2型天然产物Shizukaol D和Sargradrolide J的全合成工作(Angew. Chem. Int. Ed., 2017, 56, 637),彭小水课题组实现了type 1型天然产物Shizukaol A和type 2型天然产物Shizukaol E的全合成(Nature Commun., 2018, 9, 4040)。然而对于type 3型天然产物的全合成目前还未有成功报道的例子,考虑到这类天然产物也具有多种优良的生物活性,且从结构上看type 3与type 1和type 2具有相似性,因此,刘波教授课题组设想能否从type 1型天然产物出发,通过几步衍生化步骤来实现type 2和type 3型天然产物的构建,但不幸的是,在type 1型天然产物中B环进行直接官能团化反应得到的是不需要的非对映异构体。因此,发展一种通用的策略来实现上述三种类型的乌药烷倍半萜二聚体天然产物的构建将具有重要意义。之后,他们经过大量细致研究发现,吡啶促进地原位生成的二烯前体可以实现type 3型天然产物骨架的构建,进而合成了多个活性乌药烷型倍半萜二聚体天然产物。、
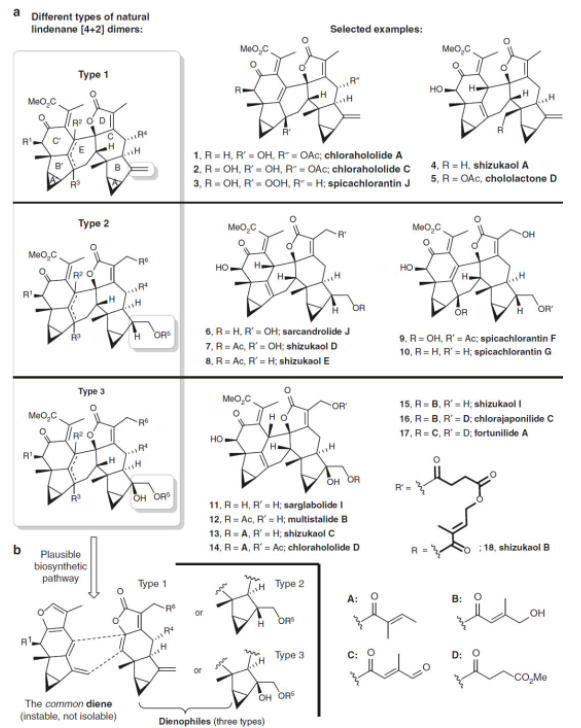
图3 三类乌药烷[4+2]型二聚体结构及其相关的生源合成途径
考虑到呋喃二烯不稳定且难以分离,刘波教授课题组在之前合成type 2型的天然产物中利用了酸介导原位生成二烯的策略来实现这类天然产物的合成(图4)。然而,他们发现,对于偕二双取代的type 1型天然产物,在利用酸促进下会发生exo/endo的环异构化过程,例如在酸条件下可以实现bolivianine到isobolivianine的转化。因此,他们设想,是否可以发展一种通用的碱促进的策略来实现上述三种类型的乌药烷倍半萜[4+2]型天然产物的构建。在经过对type 3型天然产物的结构研究后,他们发现,可以选取sarglabolide I作为共同的天然产物中间体,来实现对其他type 3型天然产物的发散性合成。需要指出的是,在碱实现的[4+2]反应的策略中,二烯前体的制备要比之前酸促进的环加成反应的步骤要更短(12步 vs 17步)。
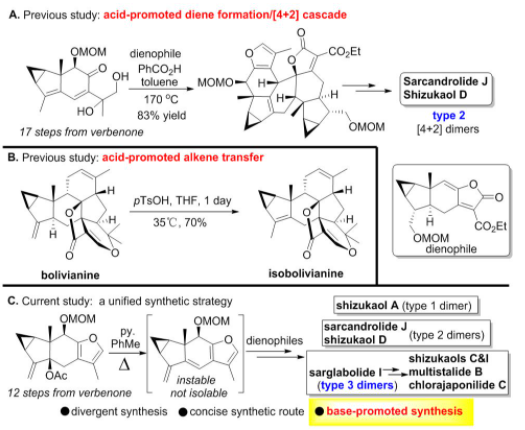
图4 从酸促进Diels-Alder反应到目前策略的演化进展
对于双烯前体的合成,刘波教授课题组以商业可得的手性试剂(+)-马鞭烯酮为起始原料(图5),经过SeO2氧化、BF3OEt2催化开环,然后在CAN存在下,与3a发生氧化性[3+2]环加成构建呋喃环,再经烯丙位氧化,进一步转化为腙,然后通过改进课题组自己发展的铑催化分子内环丙烷化反应(Chem. Commun. 2015, 51, 6179)构建出3/5/6骨架结构,最后再经烯丙位氧化、酯化和NaBH4还原等转化,可得到双烯体前体7。
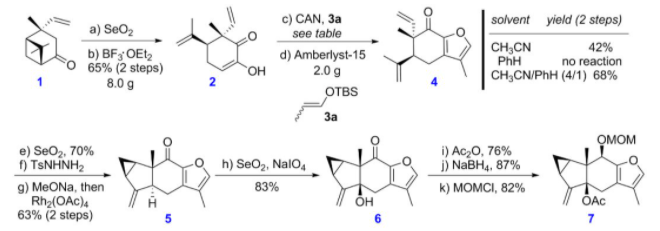
图5 呋喃双烯前体的合成
另外,对于亲双烯体的合成,课题组从以已知的中间体8出发,尝试在C4位上构建立体化学正确的羟基中间体化合物,然而他们尝试了多种策略都未能成功。例如,化合物8在锇催化的双羟化反应或者Sharpless不对称双羟化条件下,得到的是立体化学相反的产物,而在prévost反式双羟化条件下,反应得到的是烯丙基化合物或者混合物(图6)。
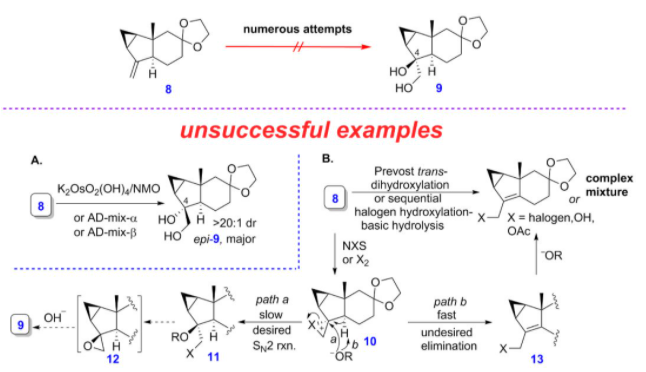
图6 亲双烯体的合成尝试
最后,他们发现,化合物8经臭氧断裂反应,在后处理时不加入任何的还原剂,可以得到目标化合物14为主产物,此时会伴随着少量的差向异构化副产物15的生成,接着他们尝试利用大位阻的乙烯基金属试剂实现酮羰基加成的同时抑制C5的异构化,结果得到的都是异构化的副产物15(图7)。之后,他们发现利用小位阻的乙烯基锂作为亲核试剂,可以实现对化合物14加成,在得到目标产物16的同时能抑制异构化过程。研究表明,该反应的温度对实验结果影响明显。所得烯基化产物经过臭氧化断裂为醛,接着还原即可得到化合物9,然后脱保护、aldol缩合合成内酯前体,最后再经aldol缩合等几步转化,合成了亲双烯体片段18。
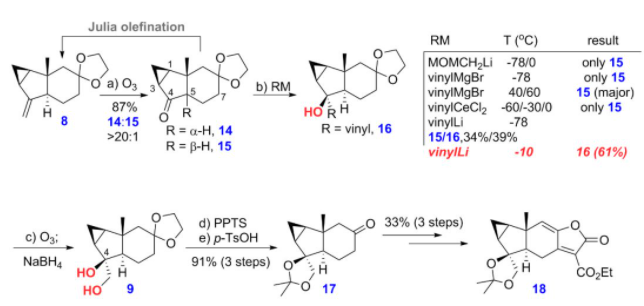
图7 亲双烯体18的合成
他们将得到呋喃双烯前体7在吡啶条件下,原位生成呋喃双烯化合物19,并与亲双烯体18在加热条件发能够顺利发生[4+2]环加成反应,该反应实现了良好的面选择性、区域选择性和endo型选择性(图8)。需要指出的是,他们能够通过仔细地调控反应温度得到了最优的产率。另外,化合物7在原位生成呋喃二烯中间体时,会伴随着Cope重排副反应的发生。
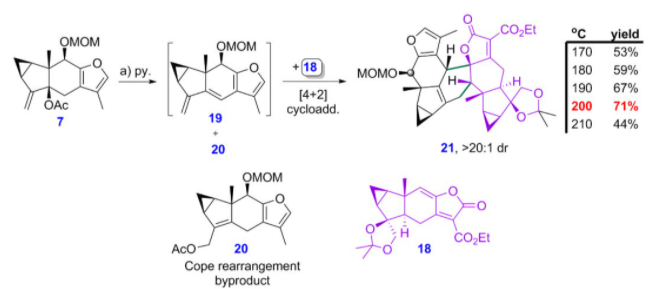
图8 关键的HOMO-活化的Diels-Alder反应优化
所得的[4+2]中间体21,可以经脱除乙二醇保护、酯基还原和呋喃氧化开环后得到可后续衍生的共同天然产物中间体sarglabolide I。而sarglabolide I经选择性的酯化后可分别生成天然产物multistalide B和shizukaol C(图9)。
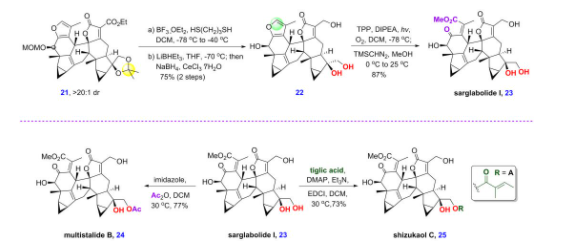
图9 乌药烷倍半萜二聚体sarglabolide I、multistalide B和shizukaol C的全合成
此外,天然产物sarglabolide I可与26经选择性酯化,生成的27再脱硅基保护生成shizukaol I。另外,27也可以进一步与29选择性酯化,之后也经过脱硅基保护生成chlorajaponilide C,之前生物活性研究表明,该天然产物具有优异的抗疟疾活性,IC50达到1.1 nM,细胞毒性研究显示,该化合物具有高的选择性因子(SI=4900),这些结果说明该化合物是潜在的抗疟疾候选药物分子(图10)。
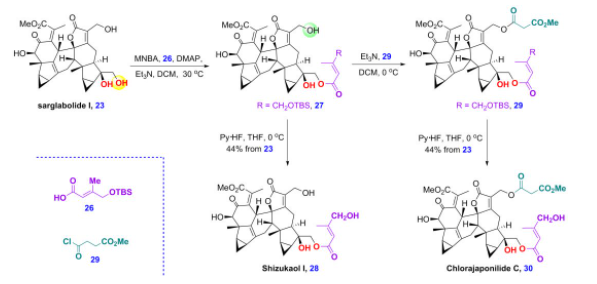
图10 乌药烷倍半萜二聚体shizukaol I和chlorajaponilide C的全合成
另外,刘波教授课题组也利用呋喃二烯前体7在吡啶作用下,分别与亲双烯体chloranthalactone A 34和32发生[4+2]型环加成反应,生成的产物经几步衍生化最终成功实现了在碱性条件下合成type 1型天然产物shizukaol A和type 2型天然产物shizukaol D和sarcandrolide J(图11)。
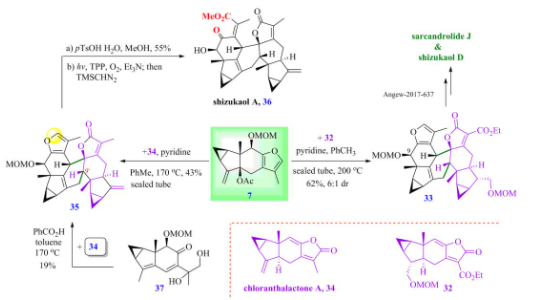
图11 乌药烷倍半萜二聚体shizukaol A、shizukaol D 和sarcandrolide J的全合成
总结:
刘波教授课题组在该工作中发展了一种有效且通用的策略来实现三类乌药烷倍半萜二聚体的合成,其中关键的碱促进的分子间Diels-Alder环加成反应具有良好的面选择性、区域选择性和endo型选择性,他们并以此为基础成功地实现了8个乌药烷倍半萜二聚体的发散式全合成。该工作毫无疑问将大大有利于后续对上述这些乌药烷二聚体天然产物生物活性的进一步研究。
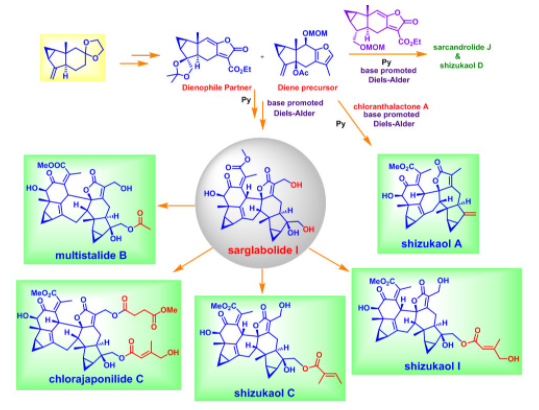
图12 乌药烷倍半萜二聚体的发散式全合成
这一成果近期发表在Nature Communication上(Nat. Commun., 2019, 10, 1892)。该论文作者为:Biao Du, Zhengsong Huang, Xiao Wang, Ting Chen, Guo Shen, Shaomin Fu & Bo Liu*。上述研究工作得到国家自然科学基金委的大力支持。
参考资料
[1]微信公众号CBG资讯(ID:BeanGoNews),【人物与科研】四川大学化学学院刘波教授课题组:乌药烷倍半萜二聚体天然产物的发散式全合成
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn