01
致力于中医药和民族药发展的代表最多
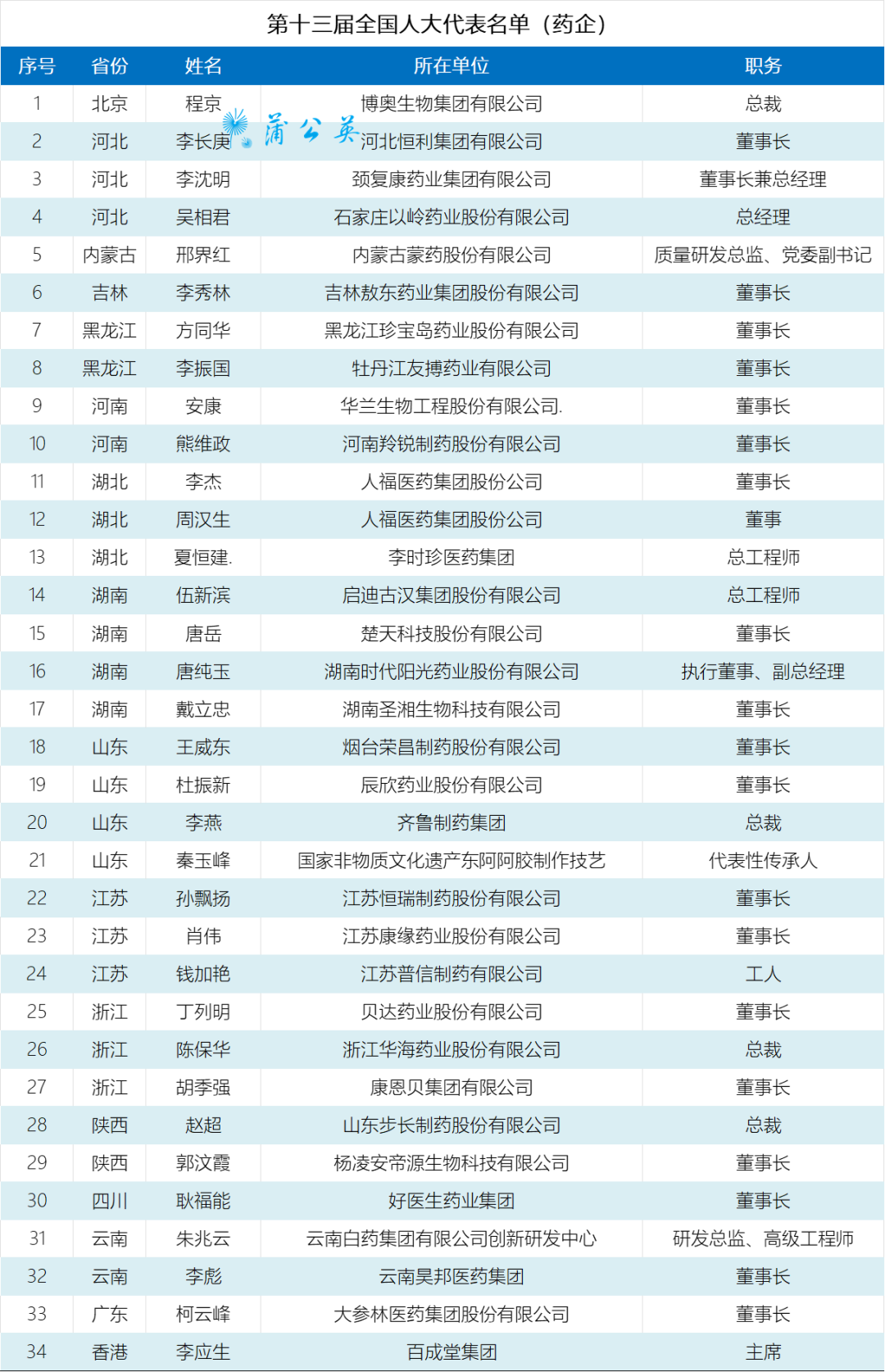
药企代表来自16个省市,致力于中医药和民族药发展的代表最多有16位。为中医药高质量发展加油。
推动中医药产业高质量发展的启迪古汉集团总工程师伍新滨;黑龙江珍宝岛药业董事长方同华;百成堂集团主席李应生;河北恒利集团董事长李长庚;吉林敖东药业董事长李秀林;颈复康药业董事长李沈明;牡丹江友搏药业董事长李振国;江苏康缘药业董事长肖伟;石家庄以岭药业总经理吴相君;好医生药业集团董事长耿福能;湖南时代阳光药业执行董事唐纯玉;河南羚锐集团董事长熊维政。
促进蒙民族药发展的内蒙古蒙药股份有限公司质量研发总监邢界红、云南白药创新研发中心研发总监朱兆云、云南昊邦医药董事长李彪。
新药研发的实践者恒瑞医药董事长孙飘扬、贝达药业董事长丁列明
致力于生物医药发展的华兰生物董事长安康、荣昌制药董事长王威东、步长制药总裁赵超
专注仿制药产业、新药研发的齐鲁制药总裁李燕 、辰欣药业董事长杜振新、人福医药董事长李杰。
02
医药相关议题
齐鲁制药集团总裁李燕提出民族医药产业创新升级发展、“一致性评价药品”宣传力度等议题。 其中,在《关于大力支持民族医药产业创新升级发展的几点建议》的建议中,李燕建议从国家层面进一步明确医药产业的战略地位,建立完整的政策支持体系,采取切实措施支持民族医药企业创新、升级、发展。在《关于加大对“一致性评价药品”宣传力度的建议》的建议中,李燕认为目前民众对通过一致性评价的仿制药仍缺乏足够的认识,因此建议从国家层面,加大面向民众、医生的一致性评价产品的多渠道宣传,推动优质高效的国产好药更多惠及患者。浙江华海药业股份有限公司总裁陈保华在医药方面聚焦于新药仿制方面,提出了“关于完善中国新药仿制政策的建议”。 陈保华认为,需要不断完善仿制药行业政策,提高行业标准与药品质量安全水平,为制药企业创造健康、良好的环境与体制保障;另外,仿制药企业要明确其核心发展领域,不断深化原料药与制剂两大产业链的一体化程度,以接轨国际高标准严要求的质量体系为基础,不断加大研发投入,培育创新动能,为国内患者提供高品质低价格的药品。对已批准上市的中国1类创新药和已批准上市且具有临床价值/优势、安全有效的中国2类改良型新药,直接赋予其参比制剂地位。对已批准上市但尚不明确其临床优势的中国2类改良型新药,由国家药品监管部门组织进行一次全面梳理评估。 红杉中国创始及执行合伙人沈南鹏提出以临床价值为导向提升药物创新能力话题。 沈南鹏认为,为了让患者从无药可治到有药可治,再到有药可选,需要更好实现新药研发和解决临床需求的共同进步,为更好实现从跟随创新向源头创新转型,应重视引导创新药企跳出传统固有思维、破除研发掣肘。因此,他建议:
一、加大资助药物创新基础研究,优化药物研发配套环境 1.在国家和省地政府层面设立适合药企与高校等科研机构共同申请的科研资金,出台更多税收激励等政策拓展社会化非盈利机构对药物研发加大资助; 2.加强对高校等科研机构科研人员新药研发的知识产权保护,探索将专利转化运用纳入高校职称评定、绩效考核等评价体系,鼓励以知识产权绩效带动药物创新的科研转化; 3.围绕“出新药”,鼓励科研机构更多进行横向合作及外部创业,从资金与资源端有规划的倾斜支持开发创新机制与靶点,创新化合物与生物药,创新平台技术等原创开发; 4.将临床试验条件和能力评价纳入医疗机构等级评审,对于全球新的靶点/药物给予临床资源的优先权,推动企医协作建立数据共享推动药物研发。 1.根据国内外监管批准动态,进一步加快更新临床指南,收紧跟随者时间窗,政策上鼓励药企提升立项和临床研究能力; 2.进一步优化药品进入临床前的会议沟通机制,提前介入原研药的研发整体策略制定并提供指导,进一步明确关键性临床设计的科学性,提升临床资源利用效率; 3.对AI在加速创新药研发中的技术运用,包括设计优化药物分子、指导临床试验方案、开发生物标记物等,建议在药物审批中给予更明确的政策支持。 1.针对尚未加入ICH但市场容量大的新兴国家,建议药监部门探索协调临床试验数据互通认证可能性,降低企业进入的经济时间成本; 2.在推动多中心临床研究伦理协作审查、研发用物品通关便利化、熟悉欧美监管体系和ICH标准的人才实训等方面提供监管和政策支持。 2022年全国两会召开在即,医药行业从业人士对创新药研发和药物可及寄予更多期盼。
2021年以来,石家庄四药有限公司共取得36项药品注册批件,有力推动了企业产品结构优化和转型。这些成果的取得得益于新修订《药品注册管理办法》及一系列鼓励药品研发创新举措的落地实施。近年来,国家药监局持续深化药品审评审批制度改革,在政策设计和具体实施上既与国际接轨,又符合我国医药产业高质量发展需求,坚定了我们开发创新药物的信心。 展望2022年,我期待药品审评审批制度改革持续深入推进,不断为我国医药产业高质量发展注入新动能。 作为长期工作在科研一线的研究人员,我切实地感受到国家近年来对创新药物研发的鼓励与支持。临床试验管理改革、药品知识产权保护等一系列政策的出台,为国内新药研发提供了良好的政策环境,也激发了中小型医药企业的创新活力。 2022年,希望国家相关部门出台更多针对药物临床前研究的指导原则和技术指南,为创新药临床前研究提供科学指导,助力更多安全有效的新药研发上市,惠及患者。 近年来,我国“互联网+医药”健康服务快速发展。作为传统线下医药零售的重要补充,“互联网+医药”能更大范围地提升公众用药可及性,更便捷地为公众提供一站式专业化服务。例如,购药环节线上线下结合的经营模式,将更好地满足公众对药品种类全、配送时效快的需求。 2022年,期待“互联网+”在提升药品可及性和用药安全性方面继续发挥重要作用,为保障公众健康安全贡献力量。
参考资料:https://mp.weixin.qq.com/s/2aD-DGXsBbWLB78_Z_vvqQ


