

北京时间5月6日凌晨,同济大学生命科学与技术学院高绍荣/高亚威教授团队与美国芝加哥大学何川教授合作在《科学》(Science)上在线发表了题为《FTO在mESCs和小鼠发育中介导LINE1 m6A去甲基化和染色质调节》(FTO mediates LINE1 m6A demethylation and chromatin regulation in mESCs and mouse development)的文章,研究发现在小鼠胚胎干细胞(mESCs)小鼠和人类组织以及小鼠卵母细胞及早期发育中,FTO可以调控染色质相关RNA,影响染色质开放与组蛋白修饰,从而影响mESCs的增殖分化以及早期胚胎的正常发育。据介绍,该研究对于解析哺乳动物及其发育中RNA m6A修饰动态调控的生物学功能,具有重要意义。

N6-甲基腺嘌呤(m6A)是真核生物mRNA内部最常见和研究最为广泛的修饰,受“书写”蛋白,“擦除”蛋白调控并经“阅读”蛋白实现功能。m6A对于mRNA的命运调控影响重大,参与剪接、转运、降解、翻译、与相分离等过程的调控。它影响了个体发育和分化等生命过程,并被发现在多种疾病特别是癌症和免疫类疾病中发挥重要作用。但m6A擦除蛋白介导的动态去甲基化在这一调控中的作用,以及其在哺乳动物发育过程中的功能仍缺少深入研究。
FTO是首个被鉴定的RNA去甲基化酶。FTO与哺乳动物发育和多种人类疾病相关,并参与癌症发生发展的调控。美国芝加哥大学何川教授和高亚威/高绍荣教授团队在研究中发现FTO敲除的杂合子小鼠产生纯合敲除后代比例偏低,且纯合敲除的雌性小鼠无法产生健康存活的后代,提示小鼠的FTO蛋白可能对于生殖发育等过程非常重要。团队利用FTO敲除的杂合小鼠自交产生的胚胎,建立了FTO敲除的胚胎干细胞细胞系(Fto-/-mESC)。研究人员分析发现FTO敲除会引起mESC中染色质相关RNA(caRNA)的m6A修饰水平上升,并且能够引发基因组水平的转录活性下降与染色质开放程度降低,这些变化会在引发细胞增殖缺陷的同时损害细胞的体内和体外分化潜能。
合作团队通过多种组学技术的联合分析发现,FTO敲除后会影响基因组中逆转座子LINE1的RNA上出现m6A修饰累积,并引发RNA的降解加速以及转录活性的下降,从而降低了LINE1的RNA丰度。不仅如此,研究者还发现LINE1 RNA下降,也影响了LINE1 对于下游靶标基因(包括2C基因和逆转座子)的转录沉默。同时LINE1附近编码基因会随着LINE1丰度的降低,而呈现明显的转录本丰度和转录活性的下降,其中包括了大量与干细胞分化和个体发育相关的重要基因。

图1. FTO调控LINE1 RNA表达和附近染色质状态以及对LINE1-containing基因表达的顺式调控
同济的研究团队利用自身在胚胎发育研究中的修饰,证明FTO蛋白缺失会影响卵母细胞的分化成熟,并且这种缺陷型的卵细胞在FTO蛋白完全缺失的情况下,将存在严重的着床与发育问题。团队成功证明FTO在卵母细胞发育和早期胚胎中参与LINE1 RNA的调控,并且同样会参与细胞核内染色质开放,LINE1下游靶标基因(包括2C基因和逆转座子),以及LINE1附近编码基因的转录活性调控。团队使用LINE1 RNA位点特异性m6A擦除系统,证明了LINE1 RNA丰度,核内染色质开发以及编码基因的异常确实由LINE1上的m6A修饰累积引发。
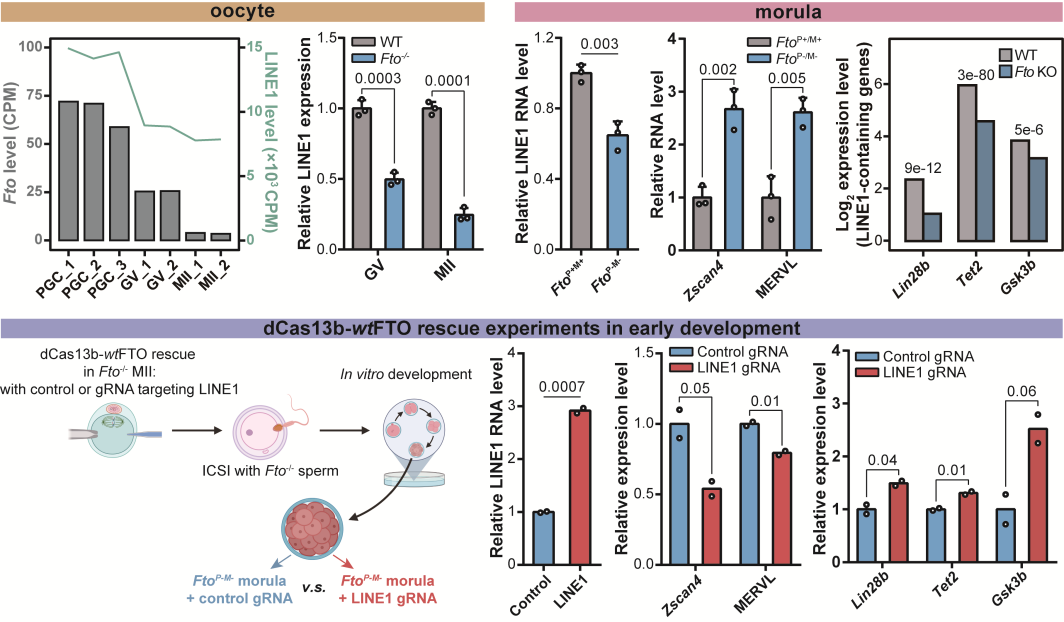
图2. FTO参与卵发育与早期胚胎中LINE1 RNA及下游基因的调控
高绍荣教授介绍,这项工作鉴定了LINE1 RNA m6A是FTO在mESCs里和小鼠发育过程中主要的功能相关底物,不仅在细胞系中阐述了FTO通过调控LINE1 RNA的表观修饰实现核染色质表观修饰和LINE1下游及富集基因表达的新机制,还在体内发育中证明了这一机制。这项工作对于我们进一步解析生命过程的分子调控机制,提供了新的研究视角。
此外,贾桂芳/何川/宋宝安教授团队利用过表达FTO使水稻和马铃薯增产50%,其分子机制可能也与植物里repeat RNA的m6A去甲基化和染色质调控相关,提示了repeat RNA的m6A去甲基化可能对不同物种体系内的表观系统都具有重要调控功能。
芝加哥大学魏江博博士、余贤斌博士,同济大学博士生杨磊、刘雪莲为论文的共同第一作者。芝加哥大学何川教授,同济大学高绍荣教授、高亚威教授为本文的共同通讯作者。浙江大学李学坤教授、南京医科大学黄伯贤副研究员和北京大学刘君研究员也参与了这一工作。该工作得到实验室其他成员和合作团队的大力支持。高绍荣、高亚威团队研究得到了科技部、国家自然科学基金委以及上海市科委等项目的支持。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn