

2015年,基因编辑这个词可谓是最活跃的科技词汇之一;CRISPR作为最受欢迎的基因编辑神器更是突破不断。虽然今年它最终没能摘得诺奖,但是技术的一次次更新和突破让科学界根本无法忽视这一技术的巨大实力和无限潜力。
Cas9酶是基因编辑系统中一个非常关键的组成部分,而脱靶效应一直是CRISPR技术需要克服的重大技术问题。在任何临床应用之前,医生和监管机构必须确保Cas9酶不会引起非目标基因组的损伤。
11月30日,发表在《科学》杂志上的一项研究中,麻省理工学院-哈佛医学院Broad研究所CRISPR大神张锋的研究小组又取得了一项突破性的成果。研究人员通过创建了3个新版本的Cas9酶大大降低了CRISPR/Cas9系统的脱靶效应;有效改善了这一技术的最大局限性之一。
张锋的团队通过改变构成化脓性链球菌Cas9酶的约1,400个氨基酸中的3个氨基酸将“脱靶编辑”显著减少至无法检测到的水平。他说,不同于其他降低CRISPR/Cas9系统错误率的方式,这些新酶的使用不需要改变许多研究人员现在参照的CRISPR/Cas9系统的protocol。
新版本的Cas9酶如何形成的?
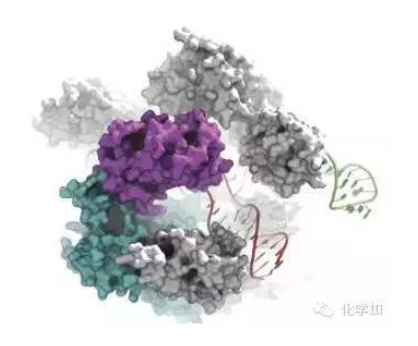
The Cas9 enzyme cuts DNA (in red) to which it is guided by an RNA sequence (in green)
在这项研究中,科学家们利用了Cas9蛋白的结构知识来降低脱靶切割(off-target cutting),即带负电荷的DNA是结合到带正电荷的Cas9蛋白的凹槽。基于这样的原理,他们预测,相较于“靶向”序列,用一些中性氨基酸来替代正电荷的氨基酸,可以减少Cas9与“脱靶”序列的结合。
在试验了各种可能的改变后,张锋研究小组发现三个氨基酸突变可大大减少“脱靶”切割。利用测试的导向RNAs,研究人员证实“脱靶”切割已降低至检测不到的水平。研究小组将这种新设计的酶命名为“增强型”化脓性链球菌Cas9(eSpCas9),可用于需要高水平特异性的基因组编辑应用。
张锋实验室马上将向全世界的研究人员提供这种eSpCas9。该研究小组相信相同的电荷改变方法也会对张锋与合作者们在今年早些时候报告的其他RNA引导DNA靶向酶,包括Cpf1、C2C1和C2C3发挥作用。
科学家如何评价新系统

并未参与这项研究的哈佛大学化学生物家David Liu 说:“这项工作实际上实在调和Cas9多余的“热情”,使它只能作用于目标序列。对很多科研应用而言,使用不变的Cas9也一样可以。但是当用于治疗领域时,研究人员希望能够降低错误率,使之不超过人类细胞正常的DNA突变率。在治疗应用中,我们都希望程序能够以最大的准确度发挥作用,确保不能编辑到基因组中预想之外的位点。”
张锋将对CRISPR/Cas9系统的改善比作“让汽车变得更快”的过程:新的Cas9酶就像为CRISPR/Cas9系统加上了更大的发动机。他说:“当然,汽车提速的方法很多;同样,还可以结合其它的方法产生马力更强的酶。”
张锋近期部分成果一览
在文章的第三段,笔者用了“又获得突破成果”这样的说法,这是因为在CRISPR领域,张锋确实是论文非常高产的研究者之一。以下是今年下半年张锋发布的部分CRISPR相关的文章(以发布时间排序):
1. 张锋Cell子刊:第二类CRISPR-Cas基因组编辑系统(10月22日)
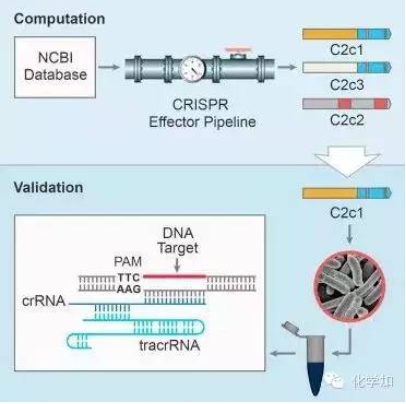
一个国际CRISPR-Cas研究人员小组发现了自然存在的、具有基因组编辑潜力的三个新系统。发现以及确定这些系统的特征有望进一步扩大基因组编辑工具箱,为生物医学研究开辟新的途径。
2. 张锋Cell重大突破:基因编辑家族“新神器”诞生,CRISPR/Cpf1让一切皆有可能(9月25日)
9月25日,发表在《细胞》杂志上的一项研究中,CRISPR技术先驱、Broad研究所合成生物学家张锋领导的研究小组找到一种让该技术更简单、更精准的方法。一种叫做Cpf1的蛋白可能将克服CRISPR-Cas9系统应用中的一些限制。虽然CRISPR-Cas9系统适用于让基因失去功能,但是对于真正实现用一个DNA序列的替换另一个还很困难。
3. 张锋Nature发布CRISPR新成果,开辟镰状细胞病治疗新途径(9月16日)
来自Dana-Farber/波士顿儿童医院癌症及血液疾病中心的研究人员发现,改变一小段DNA可以避开镰状细胞病(SCD)背后的遗传缺陷。这一发布在《自然》(Nature)杂志上的发现,为开发出一些基因编辑方法来治疗SCD和诸如地中海贫血等其他的血红蛋白疾病开辟了一条途径。
4. 张锋Cell重大突破:新型Cas9克服“哺乳动物”基因组编辑挑战(8月27日)
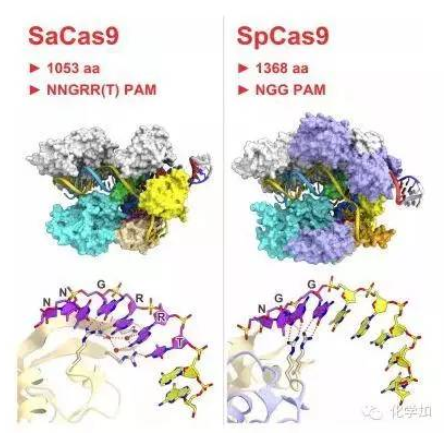
发表于8月27日《细胞》(cell)杂志上的一篇新研究论文中,来自Broad研究所和东京大学的研究人员揭示出了金黄色葡萄球菌Cas9复合物(SaCas9)的晶体结构——这种高效的酶克服了在哺乳动物体内进行基因组编辑一个主要的挑战。
5. 张锋参与Cell发布CRISPR重要新成果(7月16日)
一直以来研究人员都无法在哺乳动物细胞中实现高通量的靶向基因编辑,CRISPR-Cas9系统的应用标志着遗传筛查一个重大的突破。现在,来自哈佛-麻省理工Broad研究所的研究人员将这一筛查技术应用于小鼠骨髓源性树突状细胞,研究了PAMPs触发的免疫反应的调控机制。通过综合分析基因敲除结果及蛋白质和mRNA表达改变,他们利用CRISPR筛查以前所未有的分辨率剖析了免疫调控网络。这一重要的成果发布在7月16日的《细胞》(Cell)杂志上。
6.Genome Research:张锋CRISPR新论文(6月10日)
6月10日,来自哈佛大学医学院Dana-Farber癌症研究院、哈佛大学统计系和麻省理工学院-哈佛大学布罗德研究所的研究人员,在国际基因组研究权威期刊《Genome Research》发表题为“Sequence determinants of improved CRISPR sgRNA design”的学术论文。在这项研究中,该研究小组系统地评估了提高CRISPR筛选中单导向RNA(sgRNA)效率的DNA序列特征,并建立了一个新的序列模型,用于预测CRISPR/Cas9基因敲除实验中的sgRNA效率。
全球瞩目的基因编辑大会
12月1日-3日,来自世界各地的科学家们齐聚在华盛顿召开的 International Summit on Human Gene Editing大会,共同探讨基因编辑技术所带来的基础研究变革、潜在应用,以及由此带来的社会问题、政府管控以及法律问题等。
参会的“大咖”包括了著名遗传学家George Church,CRISPR两大女神Jennifer Doudna及Emmanuelle Charpentier、麻省理工学院-哈佛医学院Broad研究所张锋以及我国科学家中科院李劲松研究员等。
“我们希望测量这项技术在全世界的“温度”。”美国帕萨迪纳市加州理工学院病毒学家、此次人类基因编辑国际峰会主席David Baltimore说。那么,这些基因编辑领域顶级的科学家对基因编辑都持怎样的态度呢?
Jennifer Doudna
Doudna认为,人们应该商议基因组编辑研究的界限,特别是人类生殖细胞的编辑。全面禁止也许会阻碍那些可能在未来带来治疗方法的研究,考虑到CRISPR/Cas9的广泛使用和易用程度,这也是不实际的。
Doudna向科学家和政策制定者提出了五点建议,希望推动人类和非人类生物学中的CRISPR技术。具体来说,她呼吁研究人员开发出标准方法,以测定基因组编辑技术的效率和脱靶效应,从而有助于比较临床试验。她还呼吁国际社会就道德或不道德的研究出台指引。她认为,监管可确保人类基因组编辑的安全性和有效性。
George Church

Church也举了一些监管的现有例子,并认为禁止将会使这种活动转为地下,远离公众视线。他认为,禁止人类生殖细胞的编辑无异于为这种最佳的医学研究泼了一盘冷水,反而推动研究转向黑市,这带来了更大的风险和滥用;相反,我们应鼓励监管机构在安全性和有效性上的高标准,而不是怀有悲观的假设。
张锋
张锋在会上说,快速和高效的基因组编辑前景引起了许多伦理和社会关注。许多安全性问题都与脱靶效应相关。我们希望全新开发的eSpCas9将帮助解决其中的一些问题,但我们并没有将其视作为是一个神奇子弹。这一领域正在迅速地发展,在我们认为可以将这一技术投入临床应用前还有许多东西有待了解。
李劲松
尽管笔者没有收集到李劲松研究员在大会上的发言,但上周发表在《MIT Technology Review》上的一篇文章中,他曾表示,胚胎编辑是不可接受的,“纠正”生殖细胞是唯一可能的策略。
来源:生物探索,经化学加编辑
官微 化学加 2015-12-06发
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn