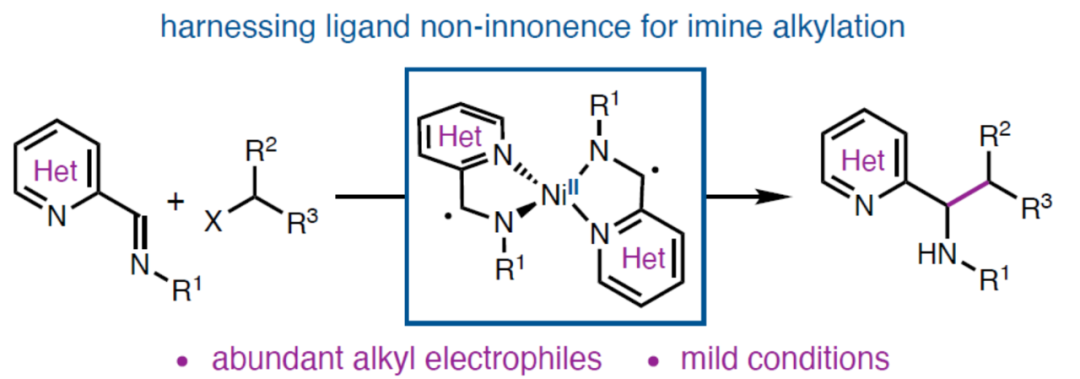
(图片来源:Angew. Chem. Int. Ed.)苄胺骨架广泛存在于各类天然产物、农用化学品和药物等中。特别是,杂苄基胺在药物化学中充当重要的含氮骨架。例如,吉利德研发的新型衣壳抑制剂Lenacapavir和辉瑞研发的治疗急性髓系白血病新药Glasdegib(Figure 1a)。目前,化学家们已开发多种构建苄胺衍生物的方法。其中,亚胺与有机金属试剂的1,2-加成反应是最成熟的方法之一,但此类反应通常需要预生成敏感性与反应性有机金属试剂以及使用活化的亚胺衍生物(Figure 1b)。当使用简单的N-烷基亚胺时,可能需要化学计量的Lewis酸添加剂来提高反应性。此外,碱性亲核试剂对亚胺底物的α-去质子化可能存在问题。为了进一步扩展合成苄胺的途径,化学家们还探索了亚胺的互补性单电子反应,包括有机自由基与亚胺的1,2-加成和亚胺的还原性烷基化(涉及α-氨基自由基)。由于避免有机金属试剂的使用,从而使该反应通常具有良好的官能团耐受性。然而,此类反应通常需要活化的亚胺衍生物来稳定生成的N-中心自由基或促进亚胺还原。近日,美国加州理工学院Sarah E. Reisman课题组报道了一种镍催化杂芳基亚胺与C(sp3)亲电试剂之间的还原性交叉偶联反应,合成了一系列N-烷基杂苄基胺衍生物(Figure 1c)。
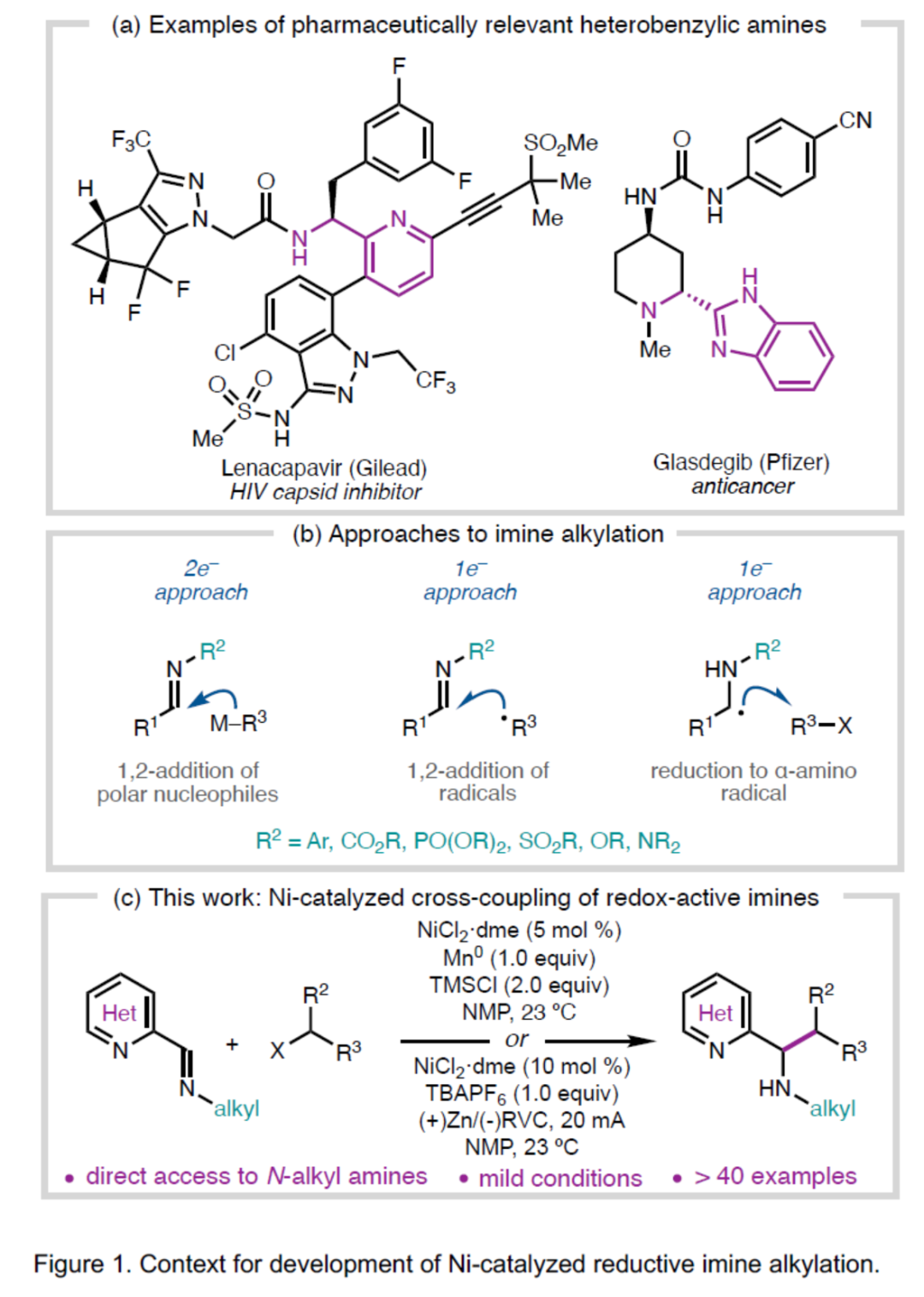
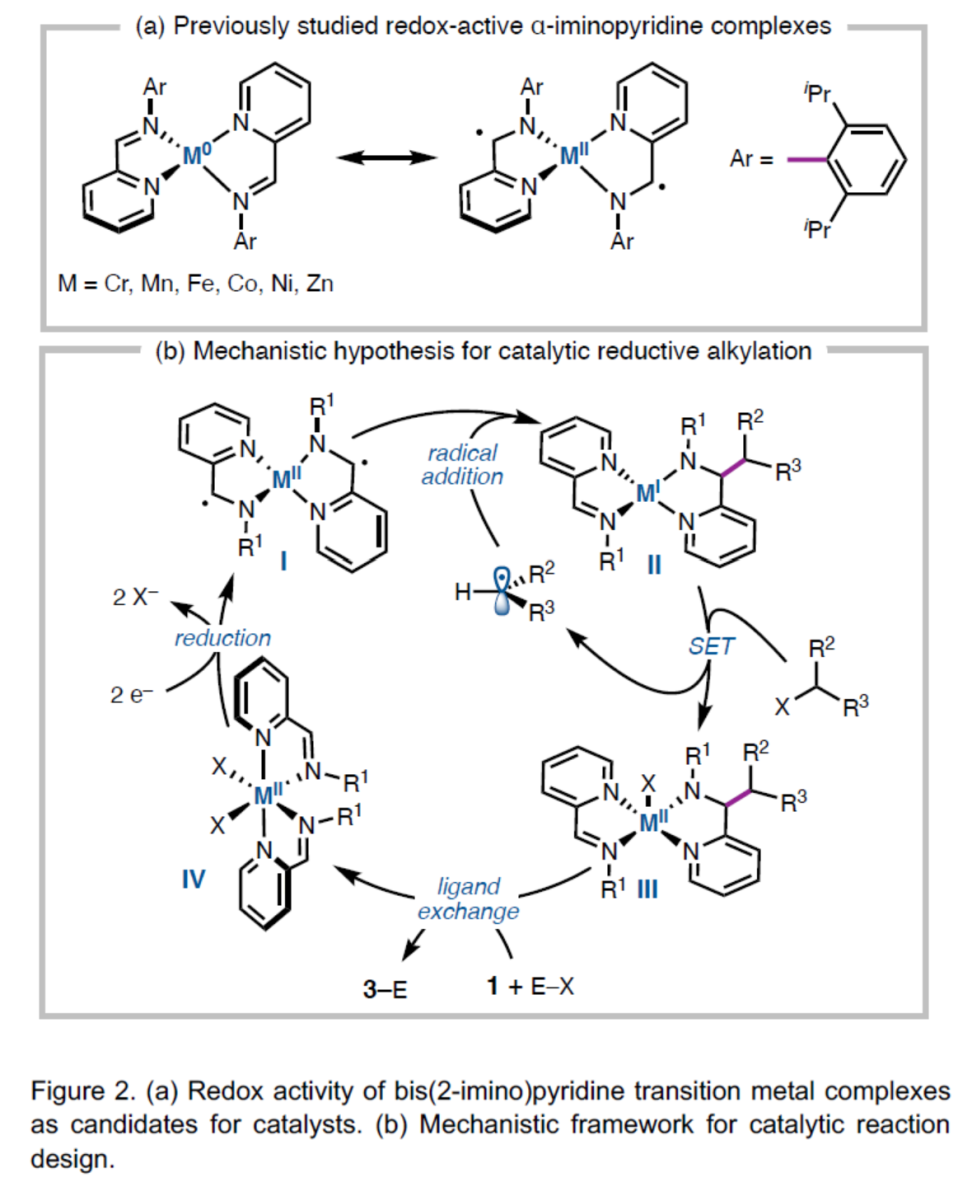
(图片来源:Angew. Chem. Int. Ed.)前期,Wieghardt 课题组通过光谱、电化学和计算研究表明,低价Cr、Mn、Fe、Co、Ni和Zn双(2-亚氨基)吡啶配合物具有以配体为中心的自由基(Figure 2a)。尽管之前已经观察到配体骨架的烷基化,但这种反应性尚未用于催化交叉偶联反应中。作者认为,这些氧化还原活性配合物是一种持久性的α-氨基自由基,它可能与烷基自由基反应生成金属配位的亚胺烷基化产物(Figure 2b,I to II)。同时,反应需完成以下条件才能确保催化过程的顺利进行:(1)烷基化产物-金属配合物II可以活化C(sp3)亲电子试剂以生成烷基自由基;(2)配合物III可与亚胺1交换生成产物;(3)双(2-亚氨基杂环)MIIX2配合物IV可通过终端还原剂还原生成低价配合物I。此外,可通过能够螯合III的阴离子氮Brönsted酸(H-X)或亲电试剂(E-X)来促进催化循环周转。
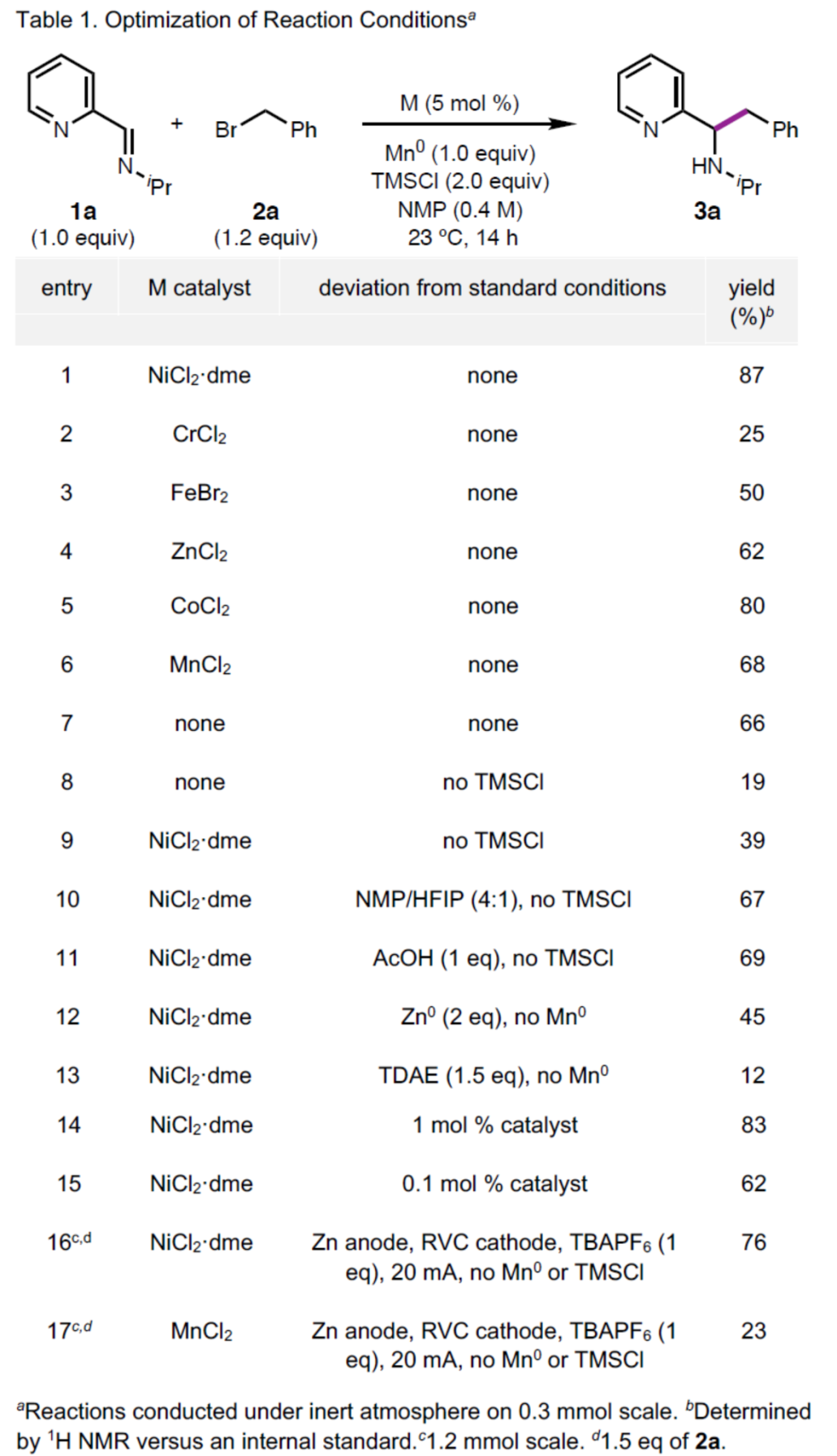
(图片来源:Angew. Chem. Int. Ed.)首先,作者以亚胺衍生物1a与苄基溴2a作为模型底物,进行了相关还原性烷基化反应条件的筛选(Table 1)。当以NiCl2·dme作为催化剂,Mn0作为化学计量还原剂,TMSCl作为添加剂,在NMP溶剂中23 oC下反应14 h,可以87%的收率得到产物3a。
(图片来源:Angew. Chem. Int. Ed.)在获得上述最佳反应条件后,作者首先对杂环亚胺底物1的范围进行了扩展(Scheme 1)。首先,当底物1中的R1为异丙基、正丁基、叔丁基、环丙基、环丁基等时,均可与苄基溴反应,获得相应的产物3a-3e,收率为67-76%。当使用衍生自(R)-1-苯乙胺的手性亚胺时,可以良好的收率获得产物3f,但对映选择性较差。当使用酮亚胺底物时,仅获得37%收率的产物3g,可能是空间位阻的增加导致。其次,当底物1中的吡啶的4-/5-位含有甲基、烷氧基时,也可顺利反应,获得相应的产物3i-3k,收率为65-74%。当底物1中的吡啶上含有卤素以及6-位含有甲基与氟取代时,反应的收率有所降低(42-59%),获得相应的产物3h和3l-3n。除了2-亚氨基吡啶外,其它的几种杂环亚胺,如苯并咪唑、噻唑、嘧啶和喹啉,均可顺利反应,获得相应的产物3o-3r,收率为48-74%。紧接着,作者对亲电试剂2的范围进行了扩展。首先,芳基上具有不同电性取代的苄基溴,均可顺利反应,获得相应的产物4a-4l,收率为45-76%。其次,苄基氯衍生物也是合适的底物,获得相应的产物3b与4j,收率为72-76%。当使用二级苄基氯也能够顺利反应,但收率以及非对映选择性均较差,如4k。此外,一系列其它烷基卤,均与体系兼容,获得相应的产物4l-4r,收率为30-80%。值得注意的是,一系列活性的基团,如羰基、酯基、卤素等,均与体系兼容,从而进一步说明了反应具有良好的官能团兼容性。
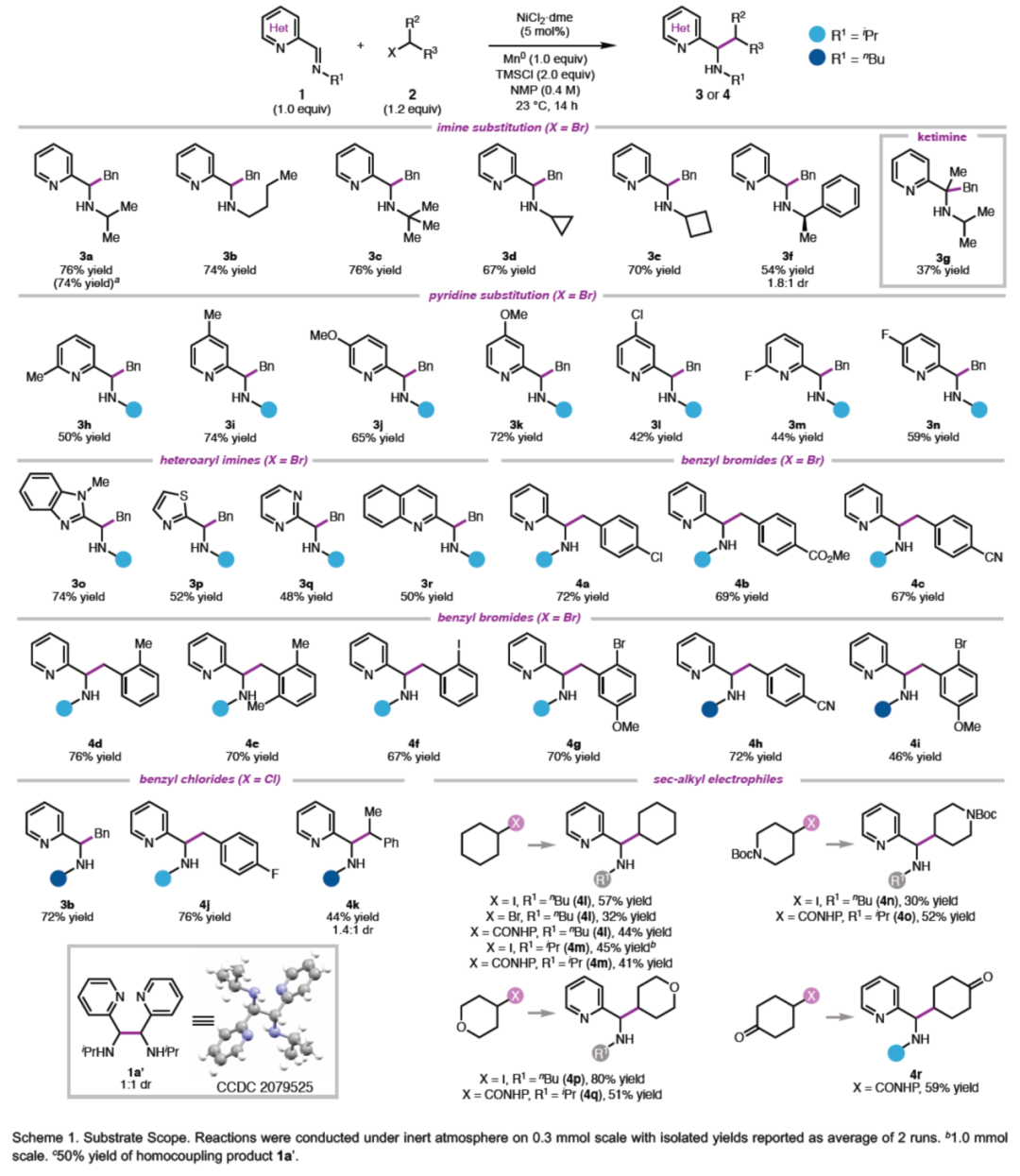
(图片来源:Angew. Chem. Int. Ed.)同时,在使用Mn0作为还原剂时,可能发生亚胺均二聚化副反应。因此,作者采用了电化学策略,从而避免了还原剂的使用。通过对反应条件的优化后发现,一系列不同取代的烷基卤均可与1a或1p顺利反应,获得相应的产物3a或4,收率为43-73%(Scheme 2)。
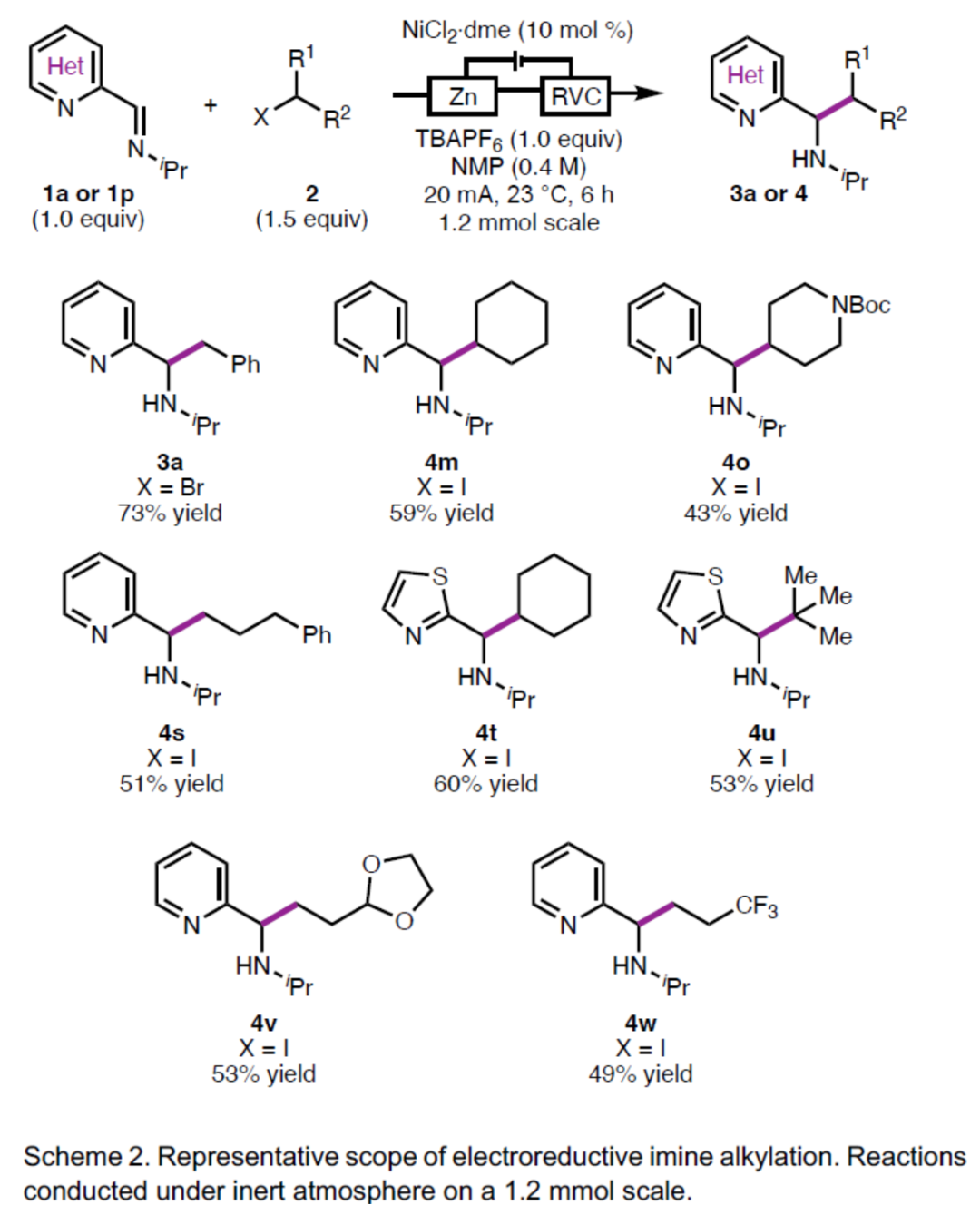
(图片来源:Angew. Chem. Int. Ed.)此外,作者还对反应机理进行了进一步的研究(Scheme 3)。首先,非螯合底物5或6在标准条件下未能进行偶联反应,从而表明了反应形成双齿底物-金属配合物的重要性(Scheme 3a)。其次,Ni(cod)2与1a原位形成的配合物9,可与BnBr顺利反应,从而表明镍配合物9作为催化循环中的活性催化剂(Scheme 3b)。此外,作者对配合物9的电子结构(Scheme 3c)以及基于金属和配体的 SOMO(Scheme 3d)进行了相应的DFT计算,从而表明还原催化底物配合物9可轻松生成持久性的α-氨基自由基中间体。
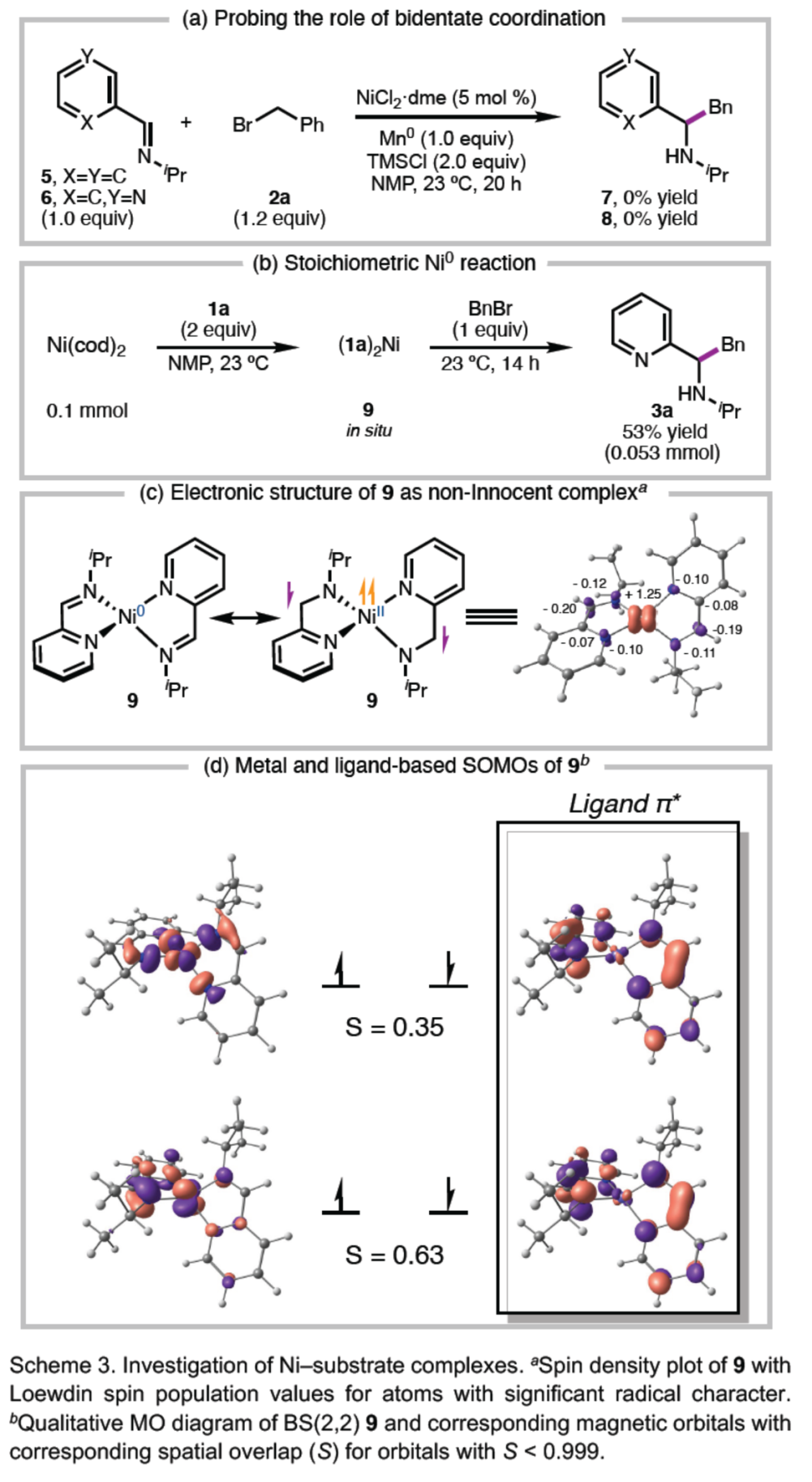
(图片来源:Angew. Chem. Int. Ed.)最后,作者还进行了相关的电化学研究(Figure 3)。研究表明,还原电位向阳极显著偏移和氧化还原的可逆性增加,从而表明亚胺与Ni和Mn的配位有助于还原并稳定以配体为中心的自由基(Figure 3a)。同时,中间体I的形成在热力学上更有利(Figure 3b)。此外,阴极位移表明,配合物10不会通过简单的EC机理与苄基氯反应,而是通过可能涉及中间化学步骤的机理,例如氯配体的离去(Figure 3c)。
(图片来源:Angew. Chem. Int. Ed.)总结:美国加州理工学院Sarah E. Reisman课题组报道了一种镍催化杂芳基亚胺与C(sp3)亲电试剂之间的还原性交叉偶联反应,合成了一系列杂苄基胺衍生物。同时,该反应具有反应条件温和、底物范围广泛、官能团耐受性高等特点。机理研究表明,形成的低价双(2-亚氨基)吡啶·Ni配合物可作为持久性配体-中心自由基配合物,可与烷基亲电试剂反应,用于C-C键的形成。
文献详情:
Raymond F. Turro,Marco Brandstätter,Sarah E. Reisman. Ligand-Enabled β-C(sp3)−H Lactamization of Tosyl-Protected Aliphatic Amides Using a Practical Oxidant. Angew. Chem. Int. Ed. 2022. https://doi/10.1002/anie.202207597











