

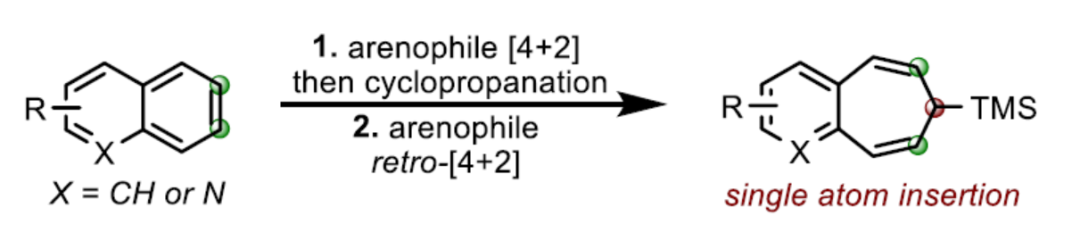
正文
苯并环庚烯是许多天然产物和生物活性化合物中常见的骨架。近日,美国伊利诺伊大学与意大利帕维亚大学David Sarlah课题组报道了一种以非活化多环芳烃为底物,经两步串联反应(涉及亲芳烃体(arenophile)的去芳构化[4+2]-环加成以及钯催化的环丙烷化,随后通过环翻转(cycloreversion)引发扩环反应),合成了一系列苯并环庚烯衍生物。同时,该策略作为Buchner反应(仅限于单环芳烃)的一种可行性替代方法。
(图片来源:Angew. Chem. Int. Ed.)
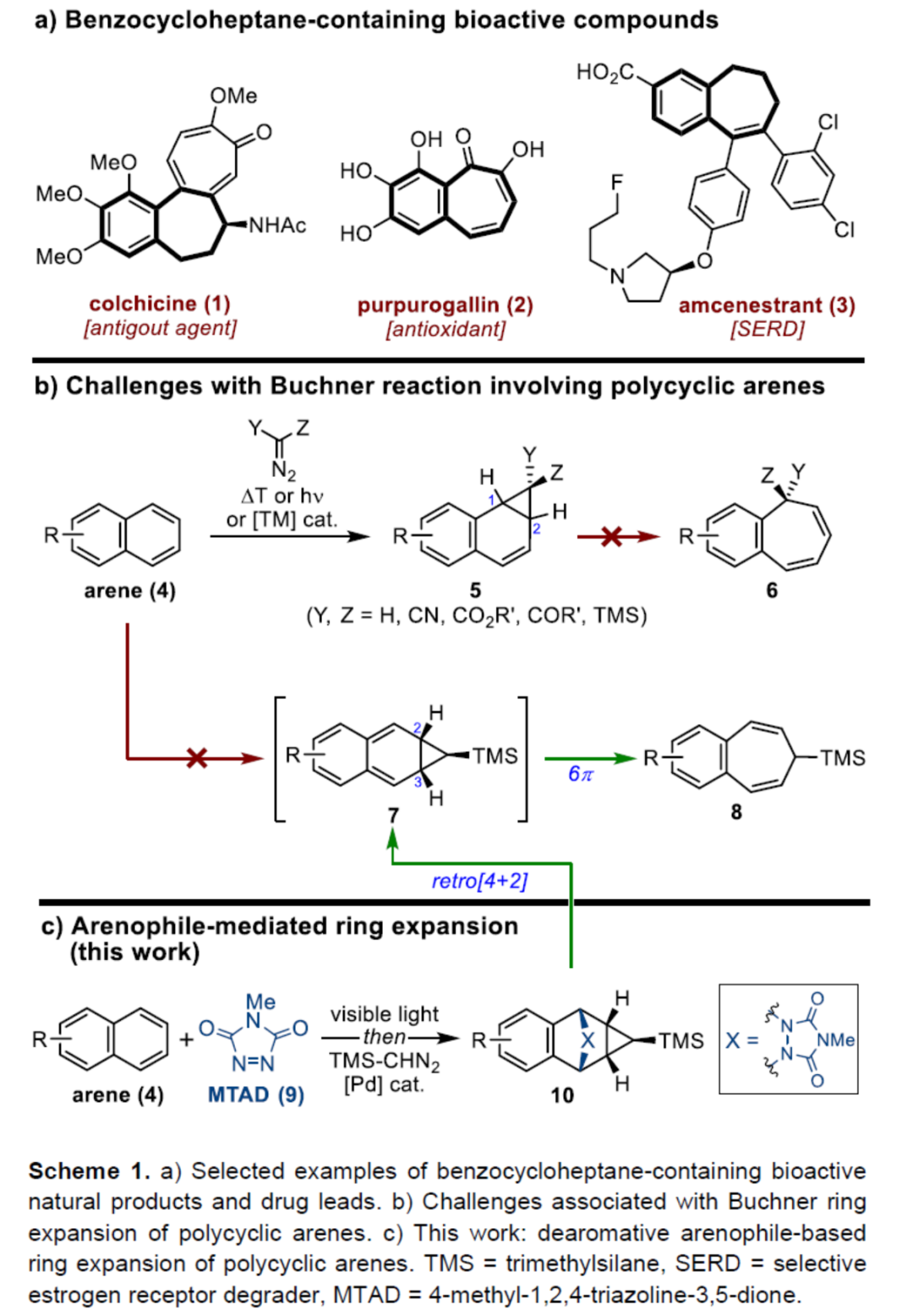
七元碳环是分子科学(如药物和材料化学)中具有价值的中间体。特别是,含有苯并稠合不饱和七元环的化合物通常是具有生物活性的天然产物和重要的先导药物(Scheme 1a)。例如,秋水仙碱(colchicine,1)是一种众所周知的天然产物,用于治疗痛风和家族性地中海热。红倍酚(purpurogallin,2)是具有多种生物活性的苯并托酚酮(benzotropolone)类抗氧化剂的中心单元。此外,这种骨架还存在于药物化学中,例如amcenestrant(3),一种研究性口服选择性雌激素受体降解剂(SERD),目前正在对激素受体阳性晚期乳腺癌患者进行研究。鉴于它们的重要性,化学家们已开发了几种合成苯并环庚烯的策略,如从环化反应到四氢萘酮和二氢萘衍生物的扩环反应。然而,此类方法常需多步操作和特定的底物,从而仅限有特定的几个例子。
另一方面,多环芳烃的去芳构化扩环是直接合成此类化合物的有效途径,但此类策略仍未得到相关的研究。Buchner扩环反应是合成环庚三烯衍生物的有效方法,涉及卡宾加成/去芳构化环丙烷化,然后是蒈二烯(norcaradienes)的6π电环化开环的过程。然而,该策略仅对苯衍生物有效。由于多环芳烃固有的反应性,环丙烷化反应经常发生在1,2-位(4→5,Scheme 1b)。由于价键互变异构过程中的几何限制和去芳香化的过程,相应的1,2-苯并蒈二烯(1,2-benzonorcaradienes,5)不易进一步扩环成苯并稠合的环庚三烯6。作者认为,环丙烷化可转移到C2-C3-位(即4→7),该中间体可迅速经电环化扩环(7→8),由同时进行的重新芳构化(rearomatization)驱动。在此,David Sarlah课题组报道了一种可见光介导的多环芳烃与亲芳烃体(arenophile)4-甲基-1,2,4-三唑啉-3,5-二酮(MTAD,9)的环加成反应,然后通过原位Pd-催化TMS-重氮甲烷的环丙烷化反应,从而合成多环化合物10(Scheme 1c)。
(图片来源:Angew. Chem. Int. Ed.)
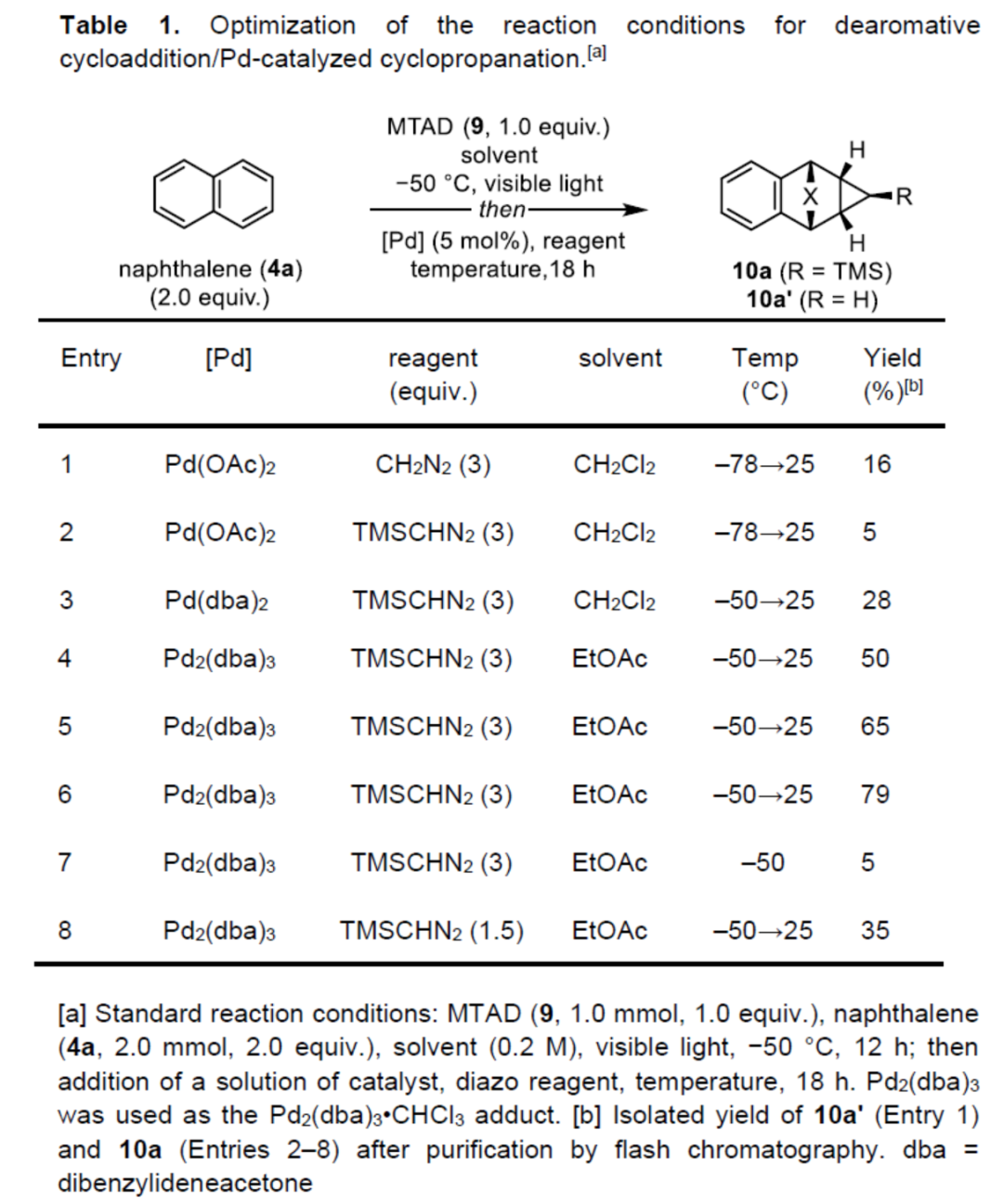
首先,作者以萘4a与MTAD(9)作为模型底物,进行了相关去芳构化反应条件的筛选(Table 1)。首先,在可见光辐射下于乙酸乙酯溶剂中-50 oC下反应,随后以Pd2(dba)3作为催化剂,TMSCHN2作为重氮试剂,并将反应温度升高至25 oC下继续反应18 h,可以79%的收率得到环丙烷化产物10a。
(图片来源:Angew. Chem. Int. Ed.)
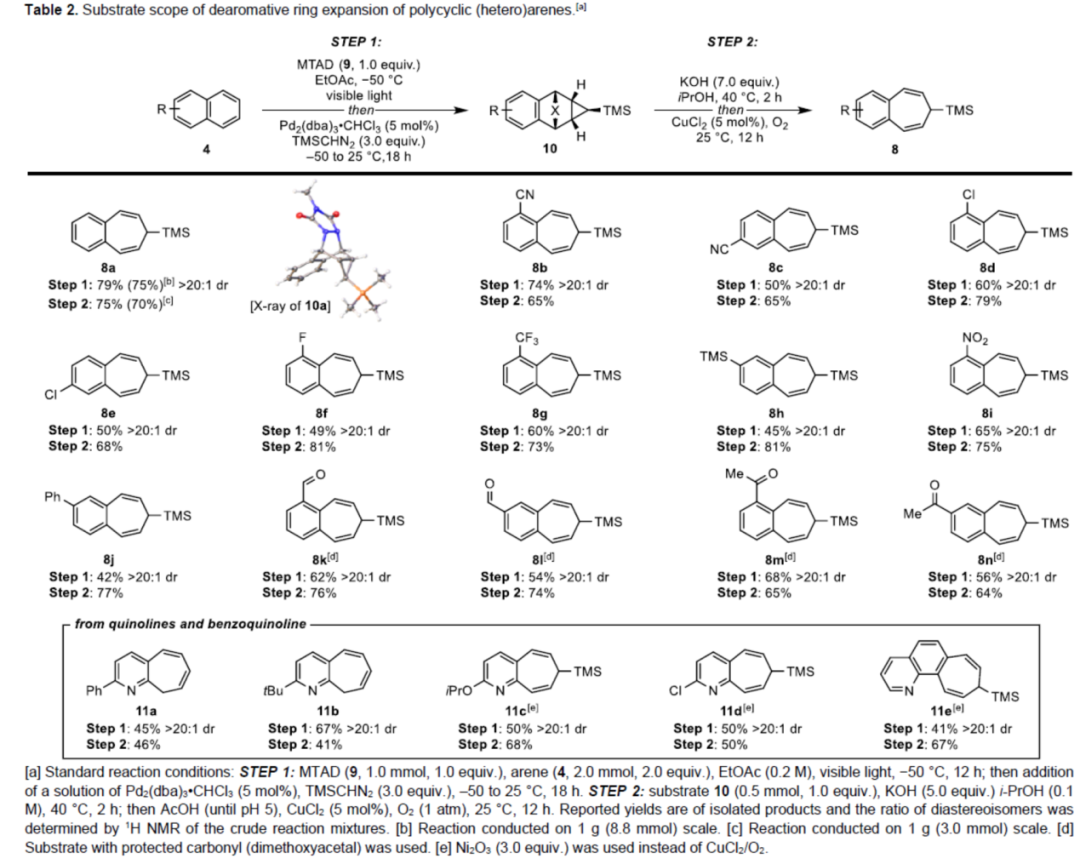
在获得了上述最佳环丙烷化反应条件后,作者对合成苯并环庚三烯的条件进行了优化。当多环产物10在含有KOH的i-PrOH溶剂中40 oC下反应2 h,然后在氧气气氛下进行铜催化的氧化,可使环翻转反应顺利进行(Table 2)。在此过程中,脲唑经部分水解/脱羧,生成的环状氨基脲中间体可进一步氧化,从而实现氮气的释放和扩环的过程。通过该策略,萘衍生的环丙烷化中间体以75%的收率生成产物8a。同时,1-和2-取代的萘衍生物,均可顺利进行反应,获得相应的官能团化的3,4-苯并环庚三烯衍生物。其中,含有腈基、卤素、三氟甲基、硅基等基团的底物,均与体系兼容。对于含有羰基和甲酰基的底物,需在环加成步骤中将其保护为相应的缩醛,并可在酸性后处理过程中进行脱保护,如8k-8n。在所有情况下,Pd-催化的环丙烷化可获得单一的非对映异构体10,其很容易自发环化为扩环产物8。同时,4a的克级规模实验,可获得与小试相似收率的产物8a。此外,多环杂芳烃(如喹啉及其衍生物),也是合适的底物,获得相应的产物11a-11e。
(图片来源:Angew. Chem. Int. Ed.)
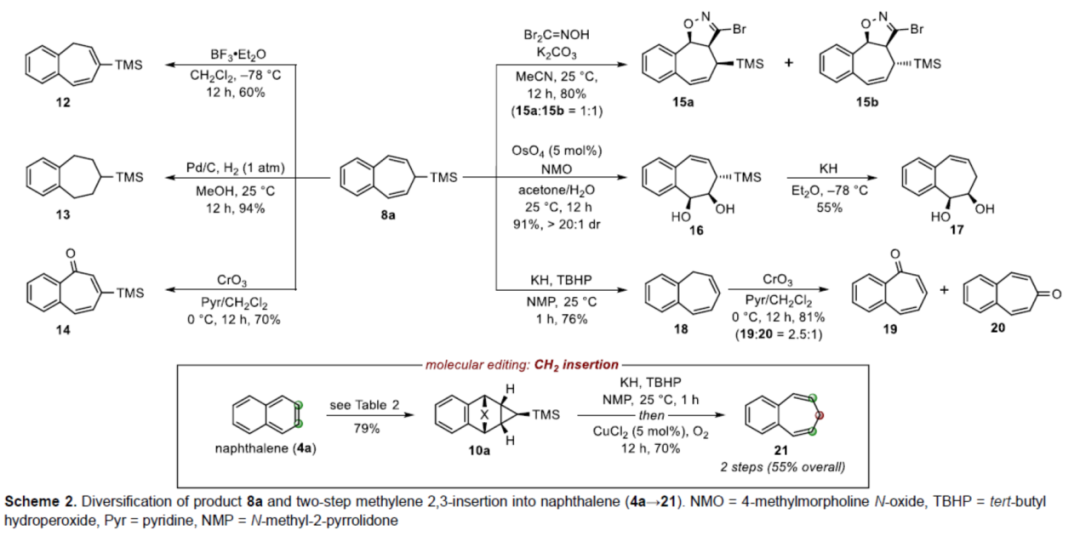
紧接着,作者对反应的实用性进行了研究(Scheme 2)。首先,8a使用BF3•OEt2催化可实现烯烃异构化(12),而在标准的氢化条件下可获得苯并环庚烷化合物(13),使用CrO3/吡啶氧化可获得2,3-苯并环庚三烯酮衍生物(14)。其次,8a与氧化腈[3+2]偶极环加成反应,可生成异噁唑啉的非对映异构体混合物15a和15b。8a经非对映选择性Upjohn二羟基化反应,可获得二醇化合物16,作为单一的非对映异构体,可经KH处理后进行去硅基化(16→17)。同时,8a中的TMS基团也可直接去除,且发生烯烃异构化,获得1,2-苯并环庚间三烯(1,2-benzotropilidene)18。18经CrO3/吡啶氧化,可获得2,3-苯并环庚三烯酮(19)和4,5-苯并环庚三烯酮(20)。最后,为了确保非取代3,4-苯并环庚间三烯(21)的合成,去硅基化与中间体10a上的环翻转步骤需同时进行(Scheme 2, inset),构成第一个直接和实用的CH2插入多环芳烃2,3-位的策略。
(图片来源:Angew. Chem. Int. Ed.)
总结
David Sarlah课题组报道了一种简单且非活化的多环芳烃和杂芳烃的去芳构化扩环策略,涉及亲核芳烃的去芳构化[4+2]-环加成以及钯催化的环丙烷化,随后通过环翻转引发扩环反应,合成了一系列(氮杂)苯并环庚烯衍生物。同时,该策略作为Buchner反应(仅限于单环芳烃)的一种可行性替代方法。
文献详情:
Paolo Piacentini, Tanner W. Bingham, David Sarlah*. Dearomative Ring Expansion of Polycyclic Arenes. Angew. Chem. Int. Ed. 2022, https://doi.org/10.1002/anie.202208014

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn