- 首页
- 资讯
JACS:炔丙基 C(sp3)-H的对映选择性以及非对映选择性发散的烯丙基化反应
来源:化学加网原创 2022-09-11
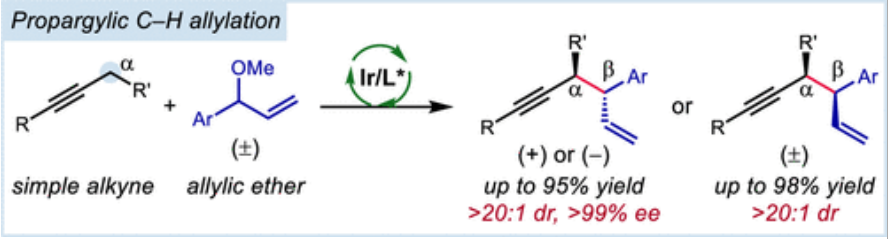
导读:近日,匹兹堡大学化学学院王亦鸣课题组实现了铱催化的烯丙基醚与炔烃立体选择性偶联生成 3,4-取代的1,5-烯炔反应。该类反应具有优异的区域选择性、对映选择性以及非对映选择性,同时具有良好的底物兼容性;更重要的是,机理研究表明金属铱起着前所未有的双重催化作用。文章链接DOI:10.1021/jacs.2c07297。
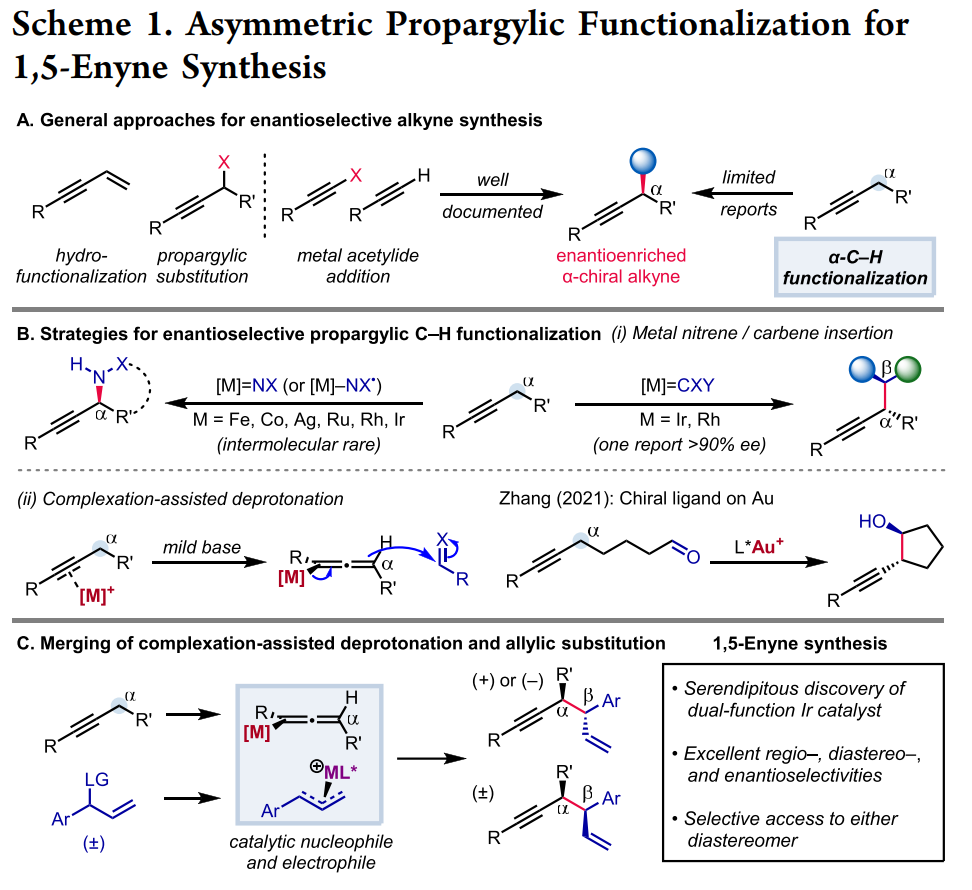
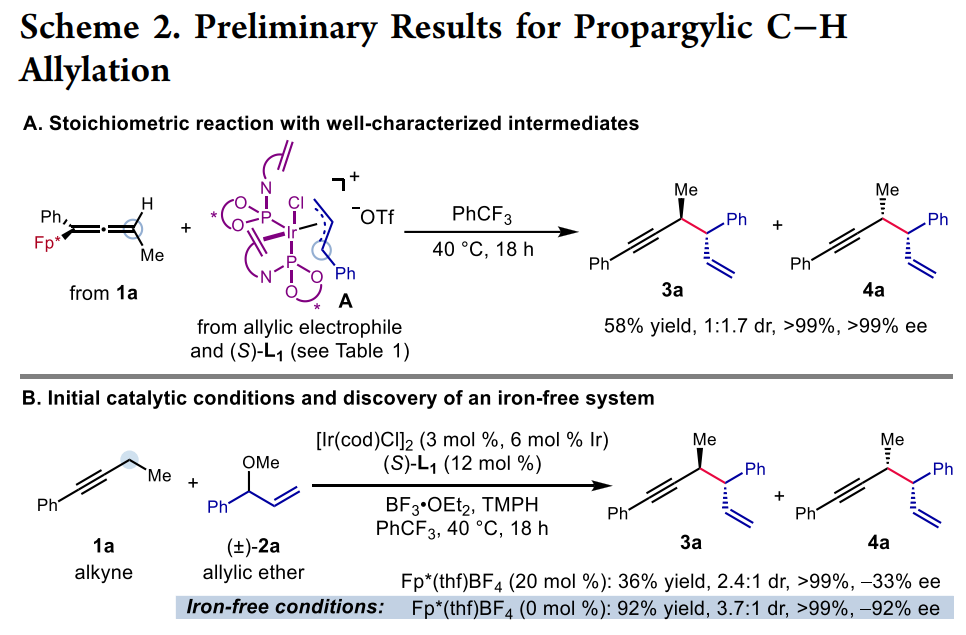
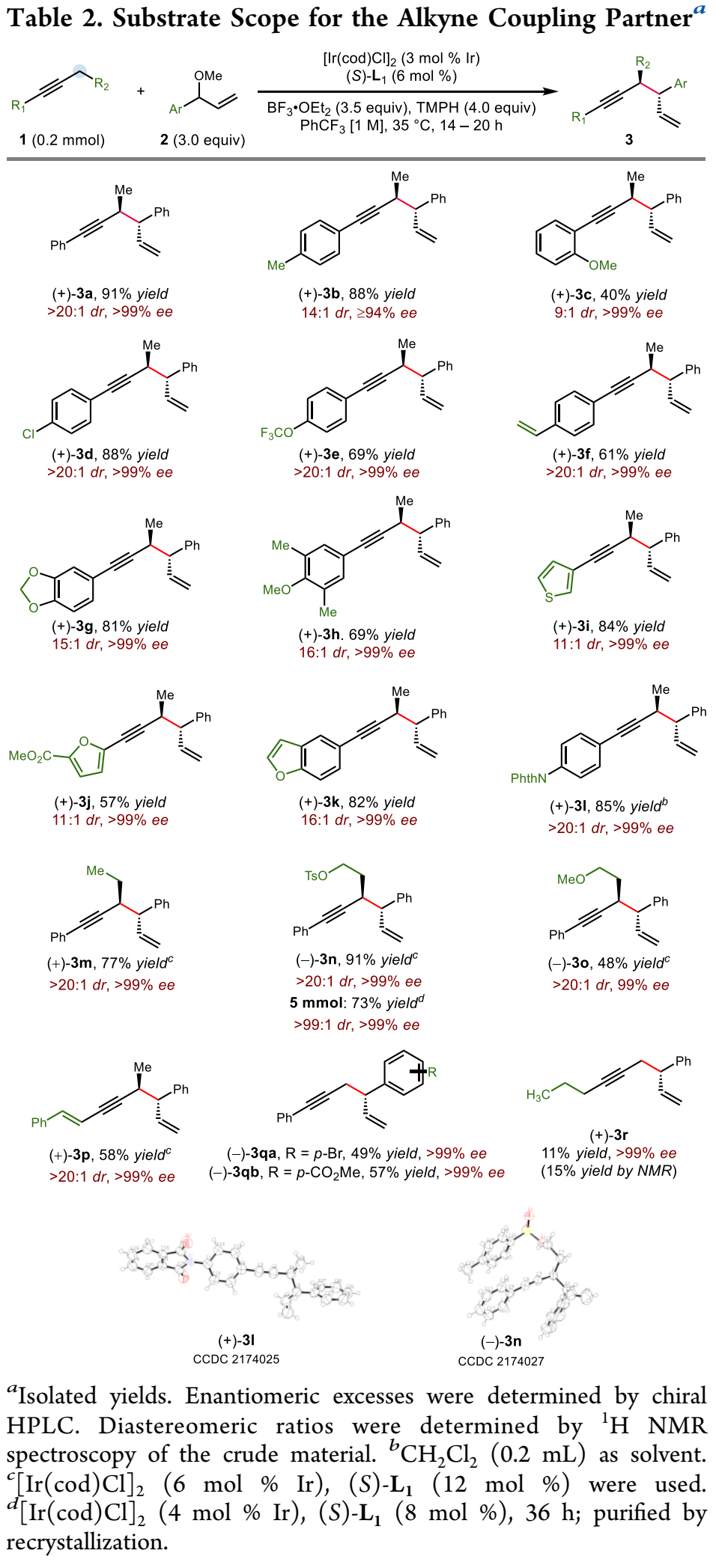
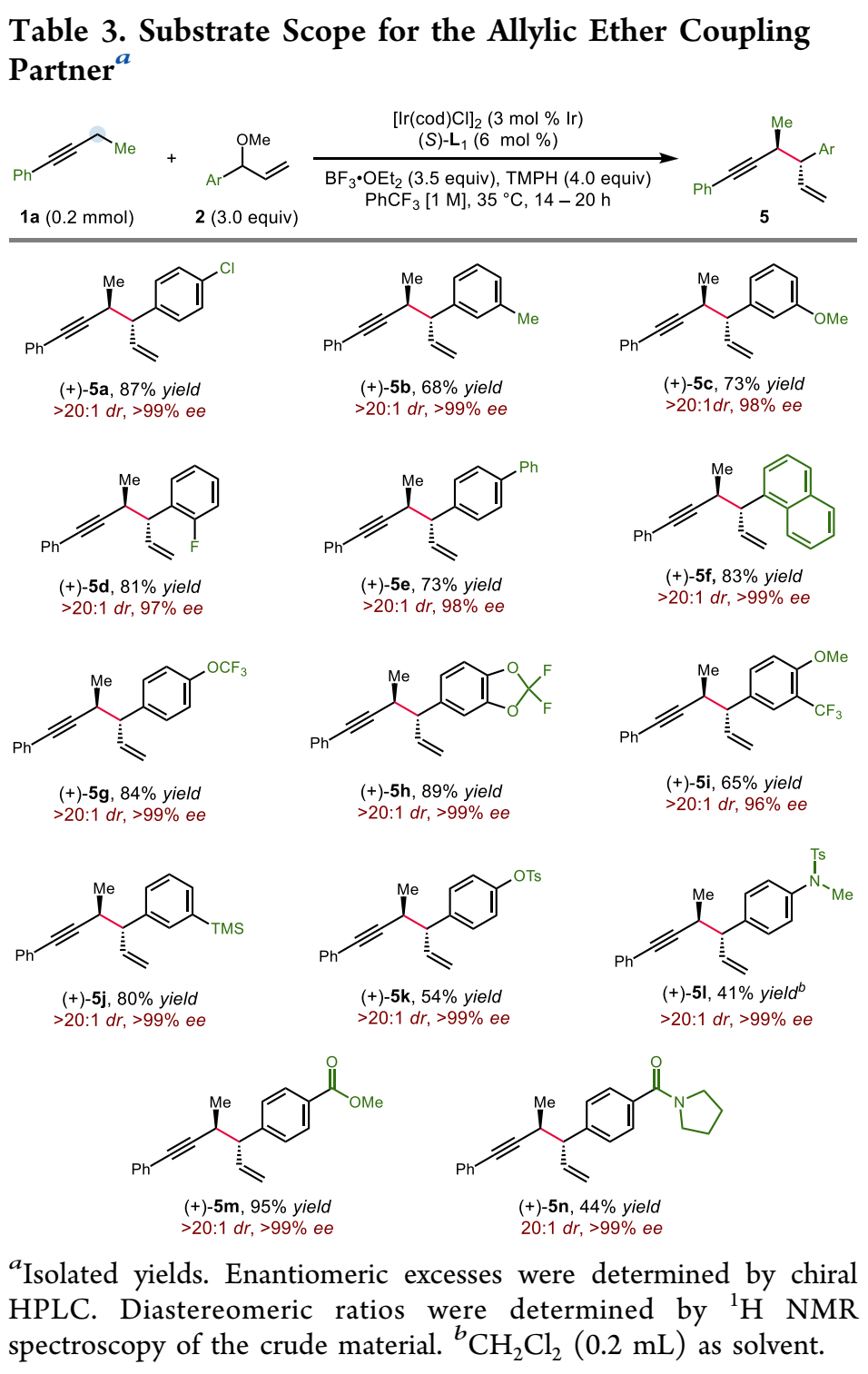
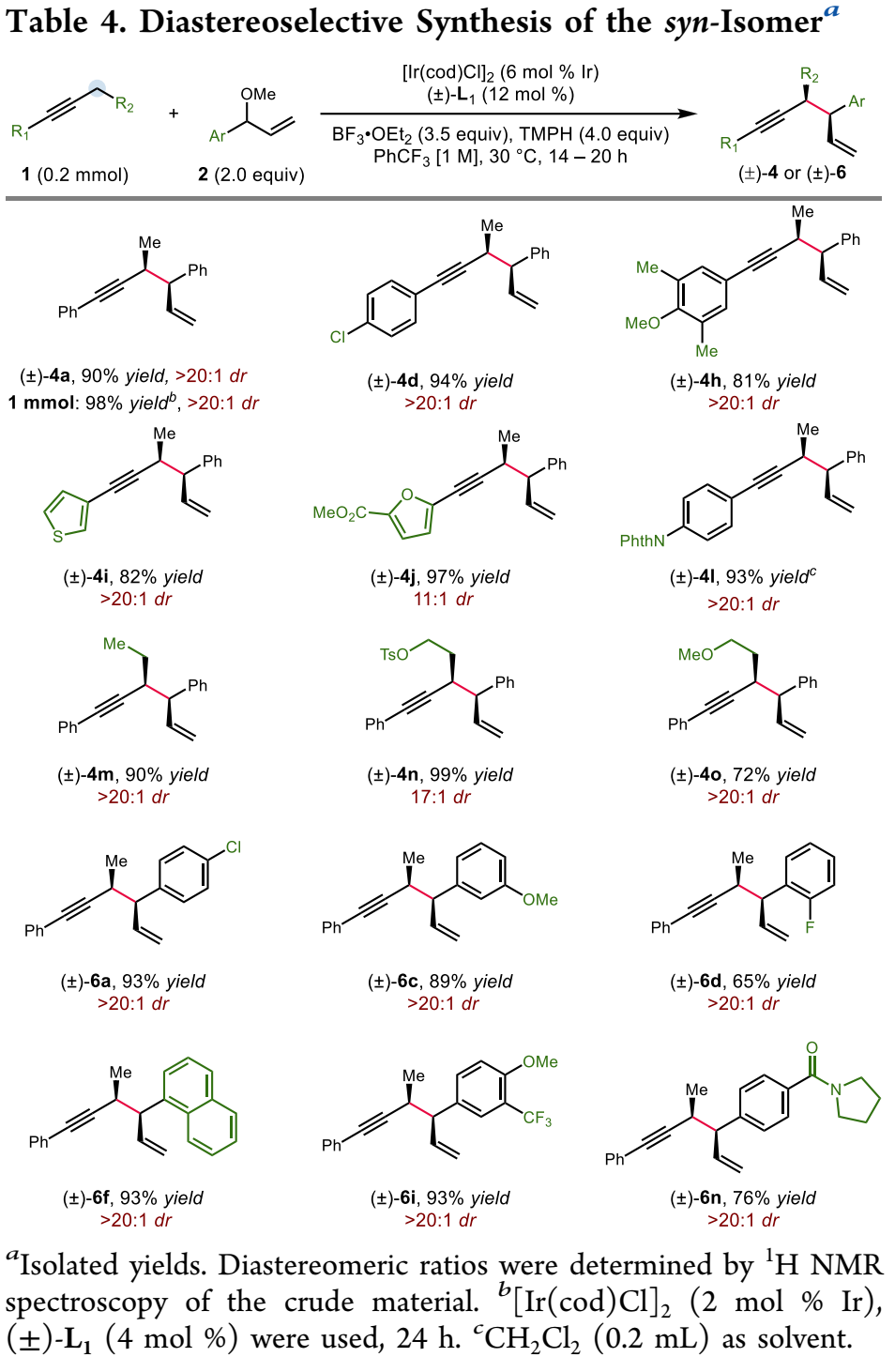
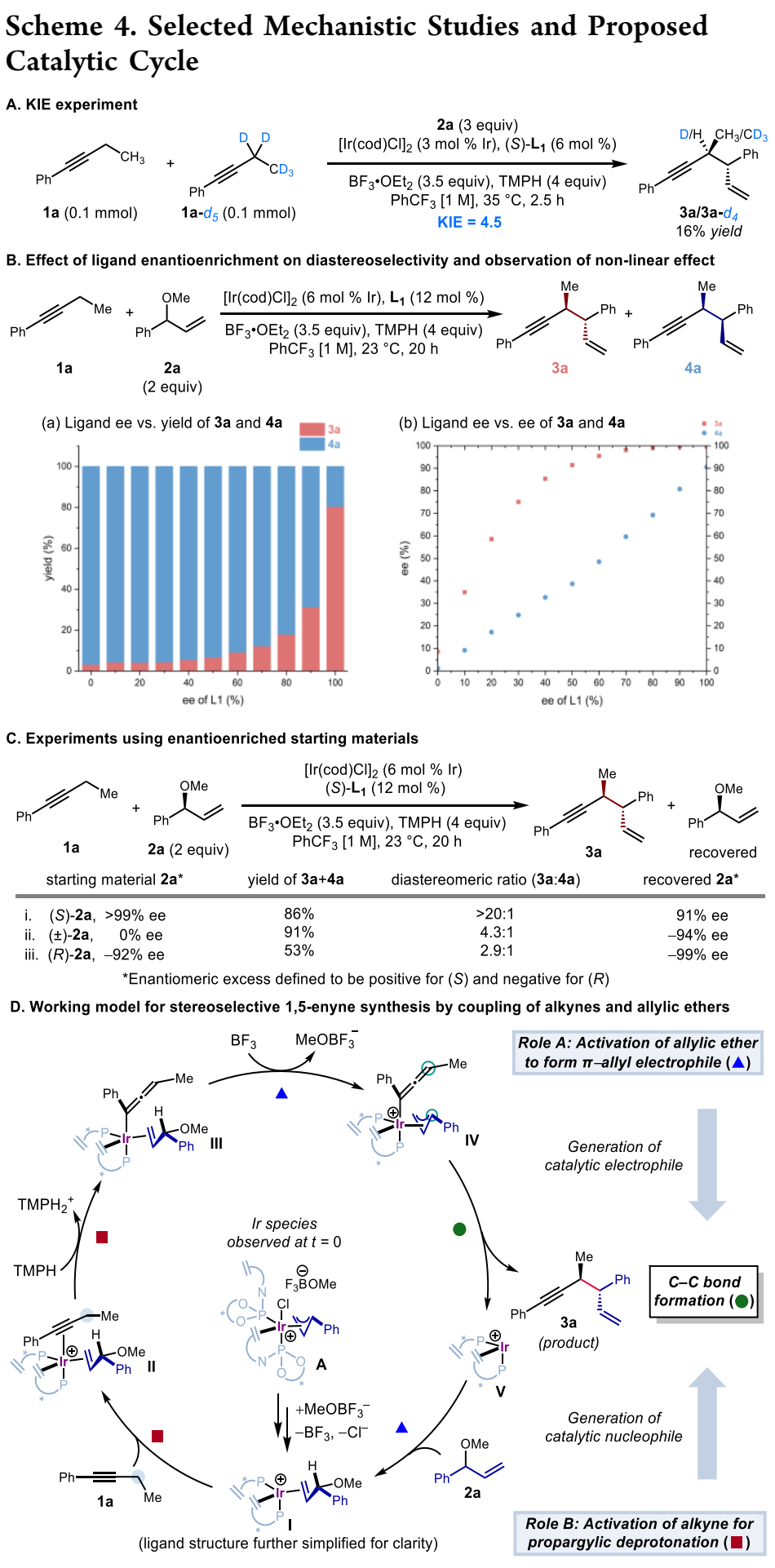
鉴于广泛存在的炔烃衍生物,在炔丙位上实现碳碳与碳杂键的不对称转化是合成复杂且多功能手性化合物的一个特别有吸引力的策略。然而,与之前的使用预官能团化的炔基衍生物的不对称炔丙基化或者使用金属乙炔化物前体对映选择性亲核加成来合成α-手性炔烃方法相比,简单的炔烃实现对映选择性炔丙基 C-H 官能团化仍然极具挑战(Scheme 1A)。金属氮烯或卡宾的插入是另外一个策略(Scheme 1B, top),不同过渡金属和配体的催化体系促进氮烯(或氮烯自由基)的对映选择性转移已有报道;此外,通过自由基-有机金属交叉机理进行的对映选择性炔丙基 C-H 官能团化反应也有研究。尽管如此,开发一种新的立体选择性炔丙基C-H官能团化策略仍然具有重要意义。王亦鸣课题组之前报道了一种催化炔丙位C-H键的官能团化方法,其中金属结合的炔烃的α-C-H键的去质子化使得随后生成的联烯基金属亲核试剂能够捕获亲电试剂,进而生成炔丙基官能团化的产物(Scheme 1B, bottom)。张立明团队进一步证明:使用手性金催化剂可以实现分子内炔丙位的对映选择性反应。在此背景下,作者设想通过之前报道过的用于炔丙基 C-H 去质子化的 Fe 催化剂,以及用于对映选择性烯丙基的Ir 催化体系结合起来,协同催化实现1,5-烯炔的对映选择性合成。为了验证这一猜想,作者实施了一个当量反应:基于Fp*的σ-联烯基铁物种(Fp* = (η5-C5Me5)Fe(CO)2)进攻之前由Carreira等人开发并表征的带有亚磷酰胺的烯丙基吡啶复合物(A+TfO-)。确实,能够以中等收率和出色的对映选择性得到所需的产物,虽然几乎无法控制非对映选择性 (1:1.7 dr) (Scheme 2A)。接下来,作者选用1-苯基-1-丁炔1a和烯丙基醚2a作为起始原料,用20%的铁与3%铱催化剂实现协同催化(Scheme 2B):可以较低收率得到目标产物,令作者惊喜的是,当体系中无催化剂铁时,产率提高到92%。这些结果表明,除了促进π-烯丙基亲电体产生之外,Ir-配合物还可以起到激活炔烃的额外作用,从而在温和的弱碱性条件下去除炔丙基质子。Ir-亚磷酰胺配合物的这种作用以前从未有过报道。作者对反应条件进一步优化,最终以较高的收率以及优异的立体选择性(91%分离收率, >20:1 dr, >99% ee) 得到目标产物3a (Table 1, entry 1),值得指出的是,烯丙基醚2a的量可以很好地提高非对映选择性(entry 1 vs 2);此外,配体与金属的比例对反应至关重要(entry 1 vs 7);当使用非手性配体 L4 时,产物的非对映选择性完全逆转,以较低的产率得到顺式非对映异构体 4a (dr >20:1)(entry 9),然而,当使用外消旋配体 (±)-L1时, 可以以优异的产率和非对映选择性获得4a (entry 10)。有了最佳反应条件,作者首先对炔丙基底物进行了考察(Table 2),对于芳环上含有富电子(3b, 3c, 3g, 3h)与缺电子(3d, 3e)基团的底物,都能以优异的收率与对映选择性进行转化;此外,一些杂环如噻吩 (3i)、呋喃 (3j)、和苯并呋喃(3k)也都能很好地兼容;一级炔丙基底物同样可以很好的实现转化(3qa-3qb),然而,当使用烷基炔时,反应效率严重下降,但可以保持优异的对映选择性 (3r)。接下来,作者对烯丙基醚底物范围进行了考察(Table 3)。一系列消旋烯丙基醚可以以中等至较高产率得到所需单一的1,5-烯炔非对映异构体。反应体系可以兼容各种取代的芳基(5a-5i),如三甲基甲硅烷基取代基 (5j)、磺酸酯 (5k)、磺酰胺 (5l),羧酸酯(5m)和叔酰胺(5n)。随后,作者把目光转移到1,5-烯炔的顺式非对映异构体的构建上(Table 4),在所有产物中,反应的非对映选择性几乎完全逆转。此外,偶联产物 (±)-4 和 (±)-6 反应效率通常高于相应的非对映体产物 3 和 5。值得注意的是,反应可以以1 mmol 规模并以2%铱催化剂的载量接近定量的合成(±)-4a 。作者进一步考察了反应的应用价值(Scheme 3)。首先,Au-催化的1,5-烯炔环异构化可以有效地获得双环 [3.1.0] 己烯 7n;此外,通过钯催化串联反应以52% 的收率且手性保持的合成三环吲哚衍生物 8n;最后,通过硼氢化、氧化以及邻甲苯磺酰化,之后与苄胺发生环化,以较高收率与对映选择性得到4,5-二取代氮杂环己烷 9n。为了对催化体系的机理更深入的理解,作者进行了一系列的实验(Scheme 4)。首先,作者对原料1a的转化时间曲线进行考察,发现反应具有一定的诱导期;将乙基被氘代的 1a-d5作为底物,在分子间竞争性实验中,观察到KIE为 4.5,表明反应存在着显著的动力学同位素效应(Scheme 4A)。综合起来,这些数据表明炔丙基质子的攫取是反应的决速歩。为了探究反应立体控制的本质,作者考察了配体的ee与产物的ee和dr之间的非线性效应(Scheme 4B)。尤其是生成的产物3a,作者发现具有明显的非线性效应,表明反应经历一个金属中心与两个配体配位的催化过程。此外,(S,S)-(L1)2[Ir] 手性复合物主要负责形成 3a。同样的,作者考察了原料2a的ee值对反应的影响,当使用消旋的2a时,反应经历动力学拆分的过程,活性较低的(R)-2a在体系中聚集;另外,当使用(S)-2a与(R)-2a构型底物时,两者的非对映选择性相差很大,结果表明,与铱催化剂配位的烯丙基醚中甲氧基的解离发生在与炔丙基配位或者去质子化过程之后。基于上面的实验结果,作者提出了可能的反应机理(Scheme 4D)。作者推测复合物A作为起始催化活性物种,失去Cl-形成烯丙基醚络合物 I,之后与炔烃配位得到阳离子中间体Ⅱ,发生去质子、脱除甲氧基,得到目标产物3a,最后,中间体V与烯丙基醚配位再生络合物I完成催化循环。王亦鸣课题组通过铱催化实现了炔丙基 C(sp3)-H的对映选择性以及非对映选择性发散的烯丙基化反应。该类反应具有广泛的底物兼容性以及优异的对映选择性和非对映选择性;此外,通过配体的改变,可以实现反应的非对映选择性的完全逆转。
文献详情:
Jin Zhu, Yidong Wang, Aaron D. Charlack, Yi-Ming Wang*. Enantioselective and Diastereodivergent Allylation of Propargylic C−H Bonds, J. Am. Chem. Soc. 2022,https://doi.org/10.1021/jacs.2c07297.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn