

(图片来源:J. Am. Chem. Soc.)
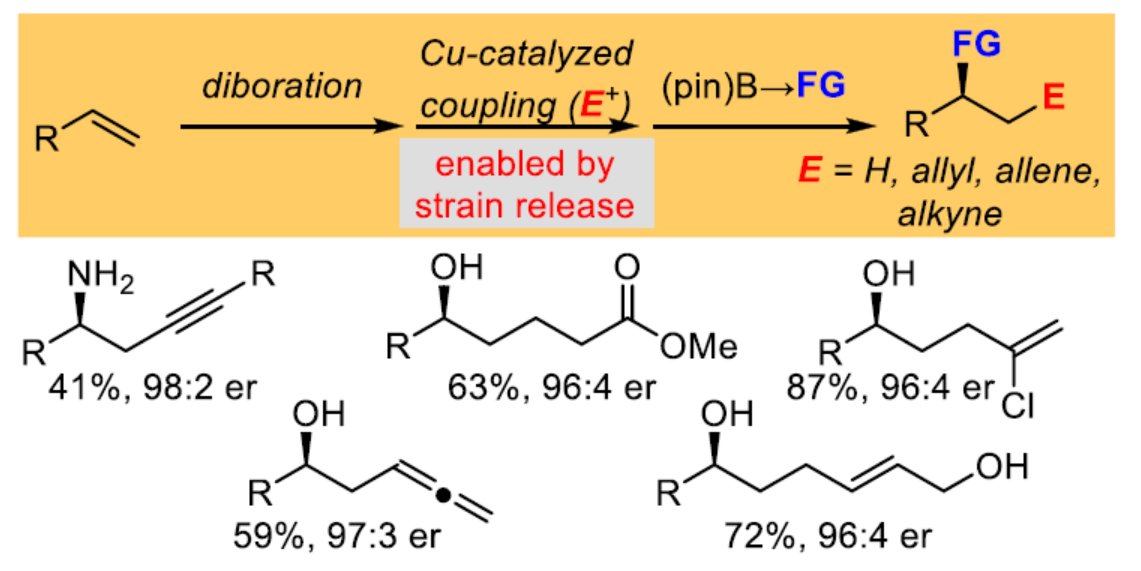
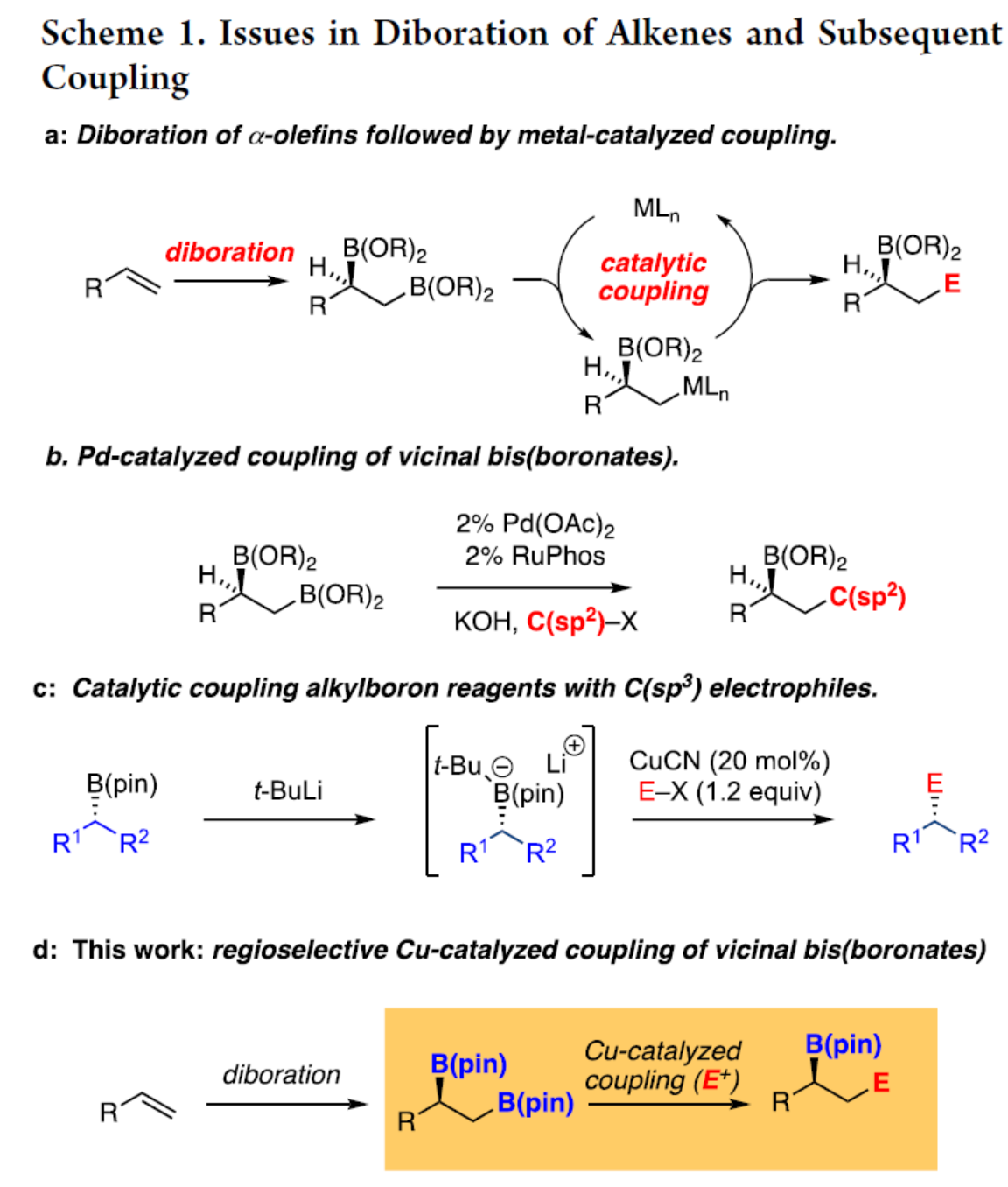
非活化烯烃的催化对映选择性双官能团化反应是当代有机合成中的一个具有挑战的课题。其中,催化不对称烯烃的双硼化反应以及随后对邻位双金属中间体进行后续转化是解决这一挑战的一种策略(Scheme 1a)。例如,通过对邻位二硼中间体进行区域选择性钯催化Suzuki-Miyaura偶联或基于类卡宾的同系化,可完成碳链的延伸,剩余的二级硼酸酯可单独进行相应的转化(Scheme 1b)。然而,该策略仅限于C(sp2)亲电试剂。为了使烷基亲电试剂参与Suzuki-Miyaura反应,化学家们已开发了各种钯、铜、镍和铁催化剂。然而,这些方法通常需要三烷基硼烷衍生物来进行反应。虽然铜催化体系可扩展到烷基硼酸酯,但直到最近,该过程同样仅限于C(sp2)亲电试剂。最近,Morken课题组报道了一种铜催化烷基硼酸酯与一系列非C(sp2)亲电试剂之间的偶联反应,其中烷基硼酸酯需使用叔丁基锂进行活化(Scheme 1c)。近日,Morken课题组报道了一种使用简单的醇盐活化,1,2-双(硼酸酯)在铜催化反应中表现出显著的反应性,可与碳基亲电试剂进行区域选择性偶联(Scheme 1d)。
(图片来源:J. Am. Chem. Soc.)
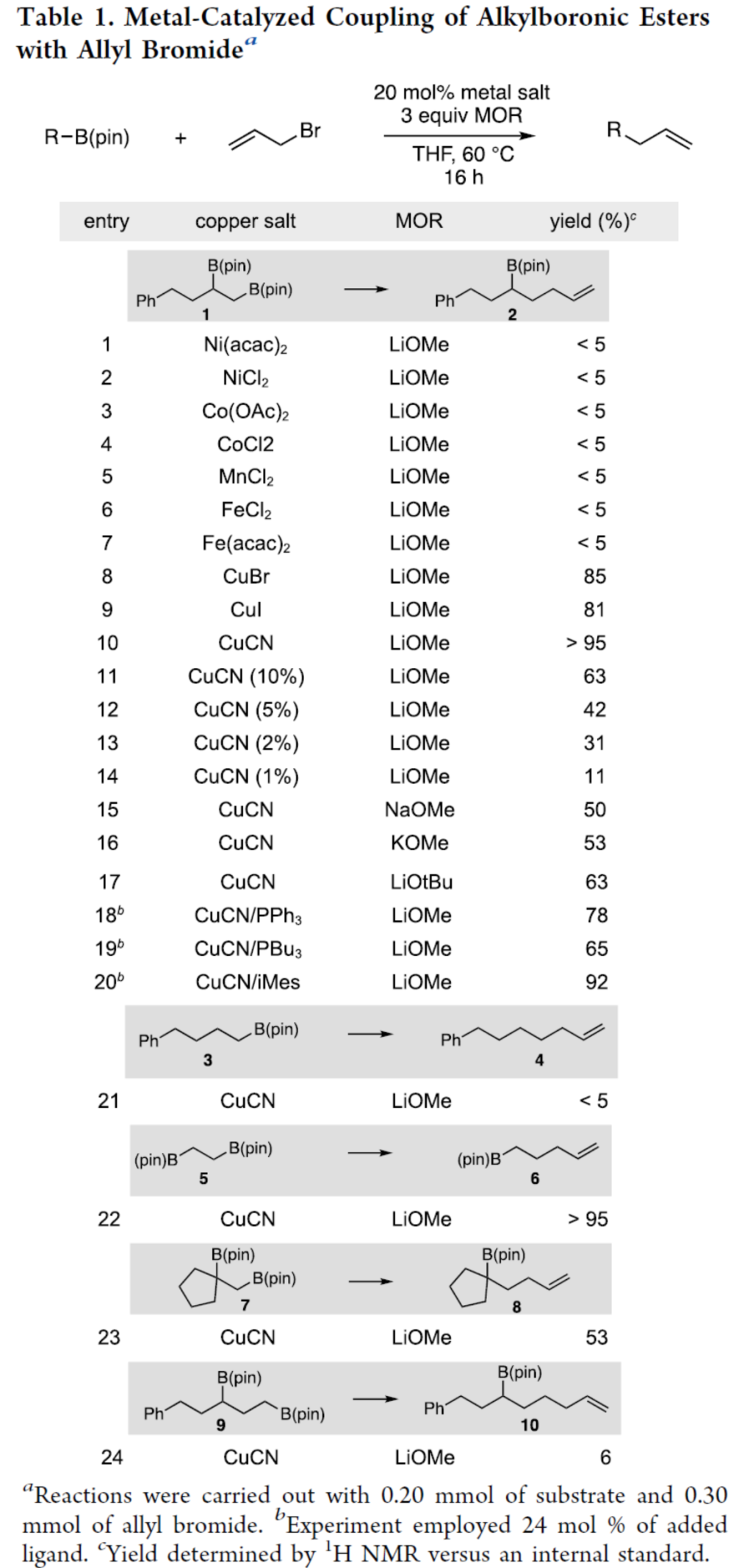
首先,作者以1,2-双(硼酸酯)衍生物1与烯丙基溴作为模型底物,进行了相关偶联反应条件的筛选(Table 1)。当以CuCN作为催化剂,LiOCH3作为活化剂,在THF溶剂中60 oC反应16 h,可以>95%的收率得到产物2。同时,在上述最佳条件下,仅有邻位二硼酸酯底物(5和7)能够顺利进行反应。
(图片来源:J. Am. Chem. Soc.)
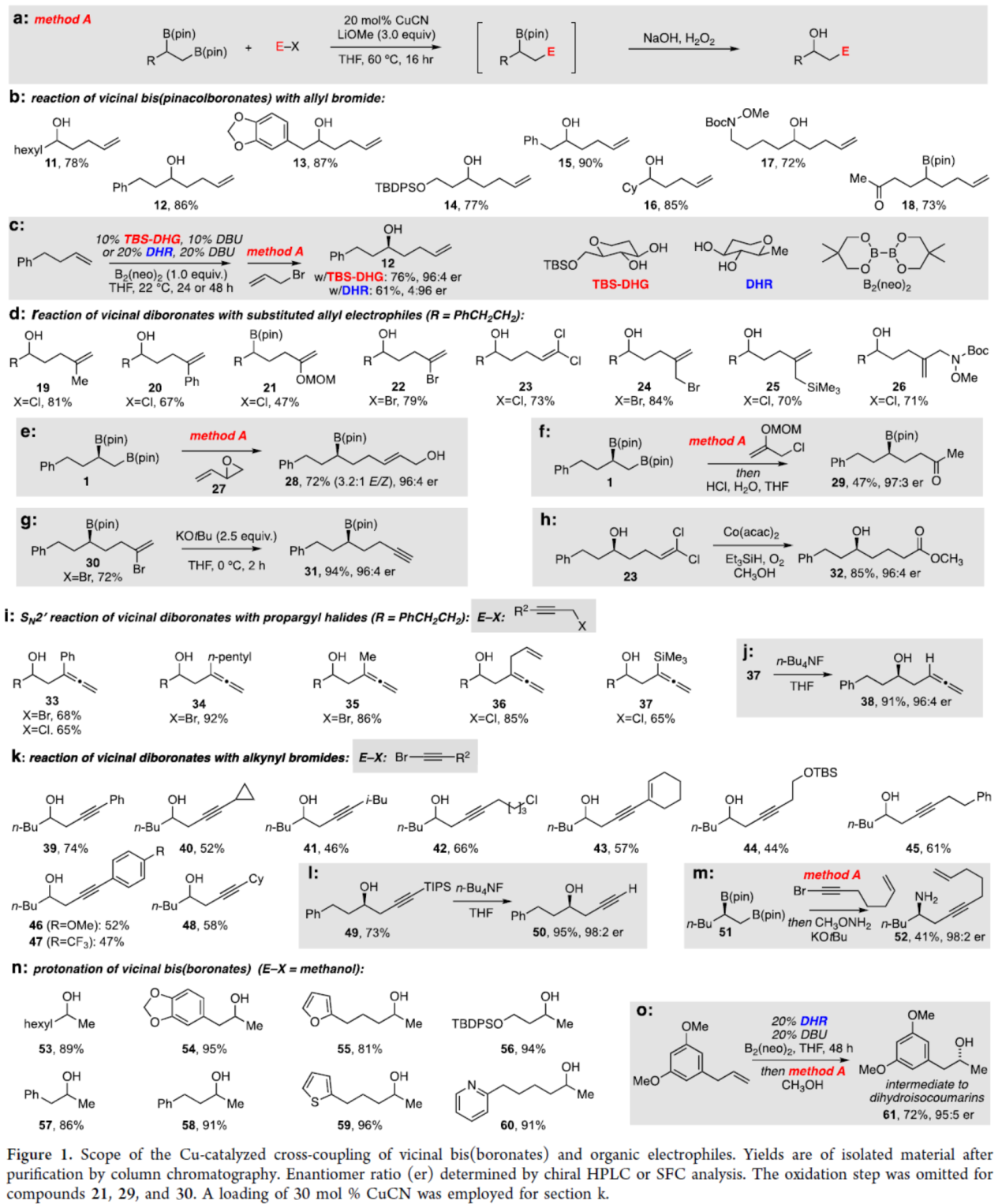
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Figure 1)。首先,一系列不同取代的邻位二硼酸酯底物,均可与烯丙基溴顺利反应,获得相应的产物11-18,收率为72-87%(Figure 1b)。同时,若将对映选择性双硼化与铜催化偶联反应相结合,可分别以76%与61%的收率获得手性醇产物12,是一对对映异构体(Figure 1c)。其次,一系列官能团化的烯丙基亲电试剂,均为合适的底物,如19-26,收率为47-84%(Figure 1d)。乙烯基环氧化物27也是一种有效的亲电试剂,可以72%的收率得到产物28,且对映体纯度保持不变(Figure 1e)。同时,通过该策略还可合成手性γ-硼基羰基化合物29(Figure 1f)、含有末端炔基的手性硼基化合物31(Figure 1g)与含有烷氧羰基的手性醇化合物32(Figure 1h)。取代的一级炔丙基卤化物以SN2'方式进行交叉偶联,以良好的收率获得取代的联烯产物33-37(Figure 1i)。其中,联烯产物37中的硅基在n-Bu4NF/THF条件下很容易去除,获得高联烯醇产物38,这是其它方法不易制备的(Figure 1j)。炔基溴化物也可与邻位双(硼酸酯)进行偶联反应,以良好的收率得到高炔丙基醇产物39-48(Figure 1k)。值得注意的是,简单的末端炔烃衍生物50很容易通过49的有效脱硅基化获得(Figure 1l)。同时,偶联产物中的硼基还可进行立体专一性胺化反应,获得高炔丙基胺产物52(Figure 1m)。此外,当使用甲醇作为亲电试剂时,反应同样可顺利进行,获得相应的产物53-60,这是其它方法不易实现的(Figure 1n)。此外,通过双硼化/质子化的串联过程,可以良好的收率以及选择性得到化合物61,这是几种二氢异香豆素天然产物合成的中间体(Figure 1o)。
(图片来源:J. Am. Chem. Soc.)
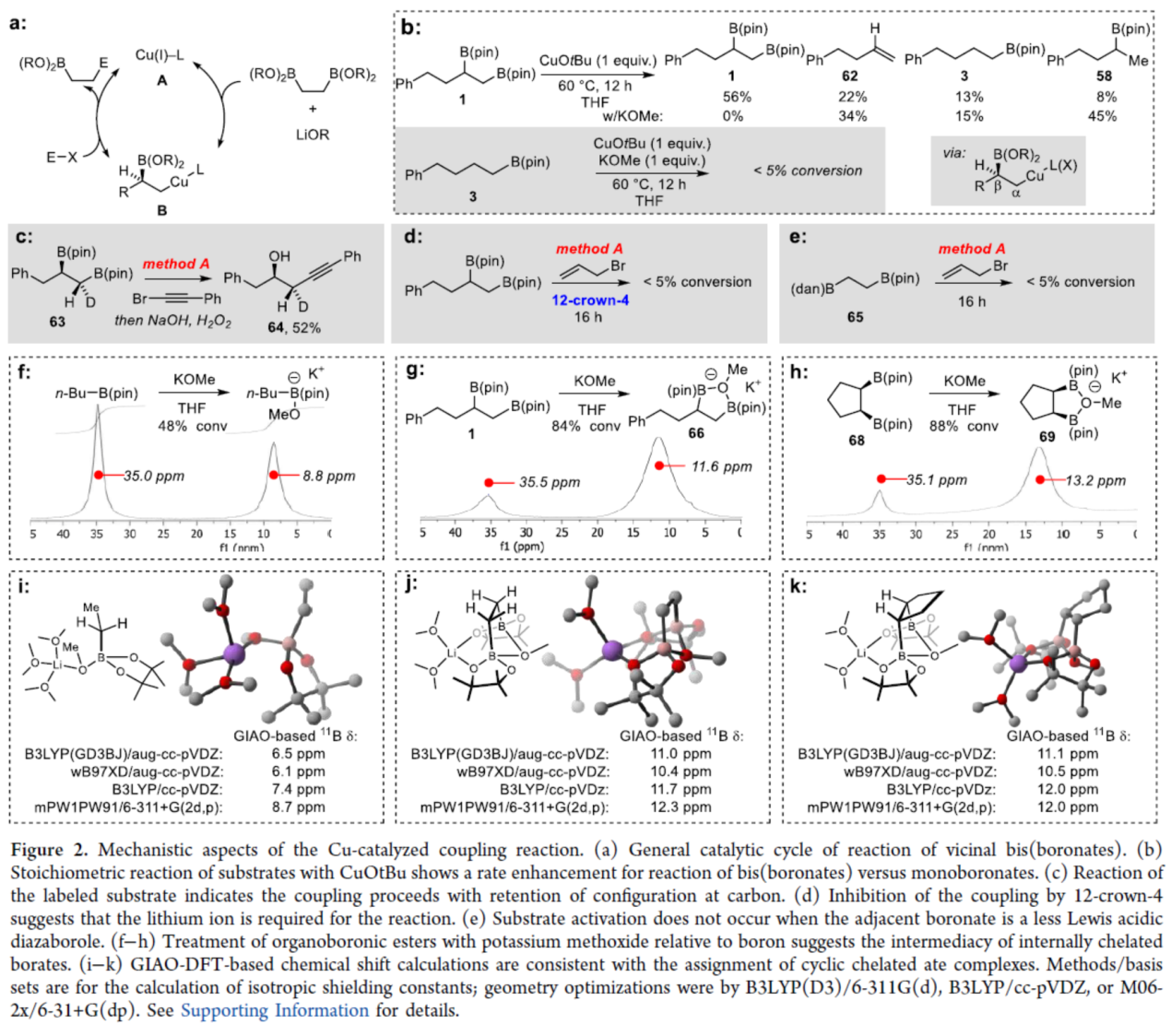
紧接着,作者还对反应机理进行了进一步的研究(Figure 2)。首先,作者提出了邻位双(硼酸酯)反应的一般催化循环过程(Figure 2a)。其中,转金属化可能直接与CuCN、Cu(I)醇盐、烷氧基衍生的铜酸盐或相关的Cu(I)盐(A)反应,以在亲电阱之前得到中间体B,从而释放铜盐和目标产物。为了进一步了解转金属化反应的性质,作者进行了一系列实验研究。通过底物与CuOtBu的化学计量反应表明,CuOtBu可加速双(硼酸酯)1到单硼酸酯58的转化,涉及中间体B的形成。同时,单硼酸酯3在与CuOtBu和KOMe进行化学计量反应时,未能进行,从而表明邻位硼酸酯基团的活化作用(Figure 2b)。其次,氘标记实验表明,一级硼酸酯反应在碳中心的构型保持不变的情况下进行,可能是通过立体保留的转金属化过程(Figure 2c),邻位硼酸酯对转金属化的活化作用可能由许多不同的机理引起。同时,12-crown-4 (一种锂清除剂)对偶联反应具有抑制性,从而表明反应需要锂离子(Figure 2d)。当相邻的硼酸酯是弱Lewis酸性二氮杂硼烷时,底物不会发生活化(Figure 2e)。上述实验表明,底物活化的机理可能涉及两个硼酸酯基团在与金属醇盐键合时的协同作用。因此,作者通过11B NMR谱研究了醇盐与几种有机硼化合物的配位(Figures 2f-2h)。研究表明,反应涉及底物中两个硼原子的键合模式。此外,基于GIAO-DFT的化学位移计算与环状螯合配合物的分配一致(Figures 2i-2j)。
(图片来源:J. Am. Chem. Soc.)
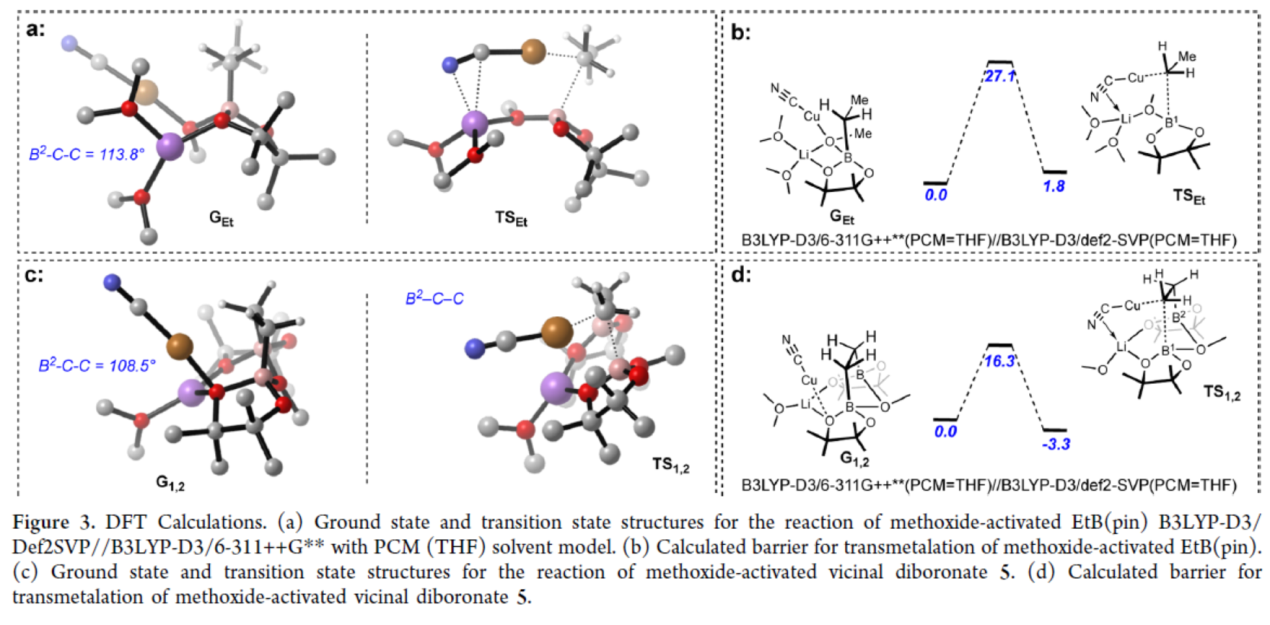
为了进一步了解1,2-二硼酸酯反应性增强的原因,作者进行了相关的DFT计算研究,以比较反应性1,2-二硼酸酯与反应性较低的单硼酸酯(Figure 3)。
(图片来源:J. Am. Chem. Soc.)
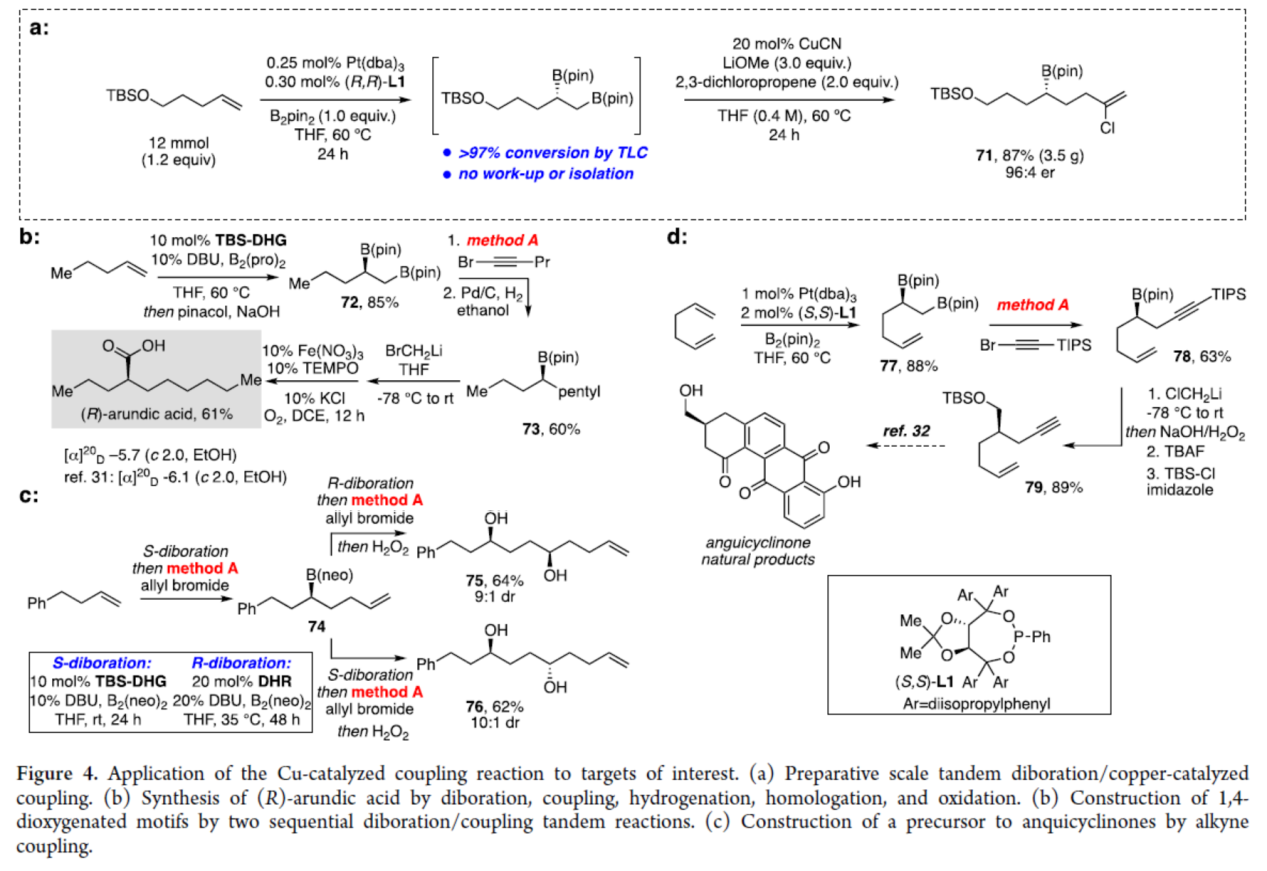
最后,作者对反应的实用性进行了研究(Figure 4)。首先,克级规模实验(串联双硼化与铜催化偶联反应),可以87%的收率得到手性硼化合物71,er为96:4(Figure 4a)。其次,通过两步法可以52%的总收率得到细胞活化抑制剂(R)-arundic acid(ONO-2506),涉及双硼化、偶联、氢化、同系化和氧化反应的过程(Figure 4b)。同时,通过两个连续的双硼化/偶联串联反应,可以立体选择性的方式构建手性1,4-二醇衍生物75和76,为一对非对映异构体(Figure 4c)。此外,通过不对称双硼化、铜催化偶联以及同系化/保护三步反应还可合成化合物 79,这是合成anquicyclinones的前体(Figure 4d)。
(图片来源:J. Am. Chem. Soc.)
总结
美国波士顿学院James P. Morken课题组报道了一种邻位二硼酸酯参与铜催化偶联反应的全新策略,可实现简单的烯烃前体直接合成具有价值的手性有机硼酸酯。同时,该策略具有反应条件简单、底物范围广泛、官能团兼容性高等特点。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn