

研究背景—Cas9蛋白递送的瓶颈
基于CRISPR/Cas9的基因编辑技术以其特异性高,具备多重基因编辑能力等优势在遗传性疾病的基因治疗中展现了极大的潜力。就在去年,Intellia Therapeutics公司与Regeneron公司合作在新英格兰医学杂志(NEJM)上发表了第一个基于CRISPR/Cas9的静脉注射药物NTLA-2001的1期临床试验中期数据,显示包裹Cas9 mRNA/sgATTR(针对转甲状腺素蛋白点洋洋变性疾病)的脂质纳米颗粒(Lipid Nanoparticle, LNP)能够在单次注射后将患者血清中TTR水平下降87%。尽管如此,直接递送Cas9/sgRNA核糖核蛋白(RNP)而非mRNA仍然具有极强的挑战性,这包括:1)Cas9/sgRNA RNP具有极大的尺寸,其单复合物分子量高达近170 kDa,难以被病毒及传统非病毒材料有效负载;2)Cas9蛋白易降解及变性,Cas9/sgRNA RNP面临蛋白酶及核酸酶降解的双重压力;3)与核酸类药物类似,Cas9/sgRNA RNP递送的组织特异性差,递送效率低。
研究亮点—本文的解决思路
目前,实现肝靶向的主要途径有以下两种:1)利用LNP包裹核酸药物,LNP在进入血液循环后表面吸附载脂蛋白E(ApoE),ApoE能够将LNP转运到表达低密度脂蛋白受体(LDLR)的肝细胞表面,由LDLR介导LNP内吞进入肝细胞中;2)在递送系统表面修饰半乳糖(Galactose)以靶向肝细胞表达的去唾液酸糖蛋白受体(ASGPR)。然而,无论是使用脂质还是在表面修饰半乳糖,都将导致一定程度的免疫原性及肝毒性。为了在实现肝特异性靶向的同时降低免疫原型及毒性,本文作者提出,使用从人肝星状细胞中分离得到的外泌体为载体,以电穿孔的方式将Cas9/sgRNA RNP负载到外泌体内,通过携带靶向不同基因的Cas9/sgRNA RNP实现对多种肝脏疾病(如:急性肝损伤、慢性肝纤维化、原位肝癌等)的基因治疗。
外泌体的制备及表征
首先,作者选择了具有高增殖率的非转化人肝星状细胞LX-2作为外泌体的供体细胞,通过差速离心的方法分离与收集LX-2细胞所分泌的外泌体。收集的外泌体再用超速离心法进一步纯化,并经0.22 μm滤膜过滤后得到外泌体重悬液。纯化所得的外泌体重悬液与Cas9/sgRNA RNP以5:1(质量比)的比例混合,然后通过电穿孔的方法将RNP负载到外泌体内部,最后再次通过超速离心法对其进行纯化,得到负载RNP的外泌体ExosomeRNP (图1)。
动态光散射(DLS)显示制备所得ExosomeRNP 的粒径为50至200 nm,透射电子显微镜(TEM)下呈现碟形的纳米囊泡结构,通过蛋白免疫印迹法(western blot)计算,ExosomeRNP的Cas9蛋白包封率约为20%。细胞水平实验表明,ExosomeRNP能够有效的将Cas9 RNP递送到人肝星状细胞(LX-2)及人肝癌细胞(Huh-7)的细胞质与细胞核中,并成功对多个疾病的靶基因进行了敲除。此外,小鼠体内实验显示,ExosomeRNP在尾静脉注射后主要分布于小鼠的肝脏部位,其分布半衰期为10.52 min,消除半衰期为154.5 min,且具备优良的生物相容性及低免疫原性。
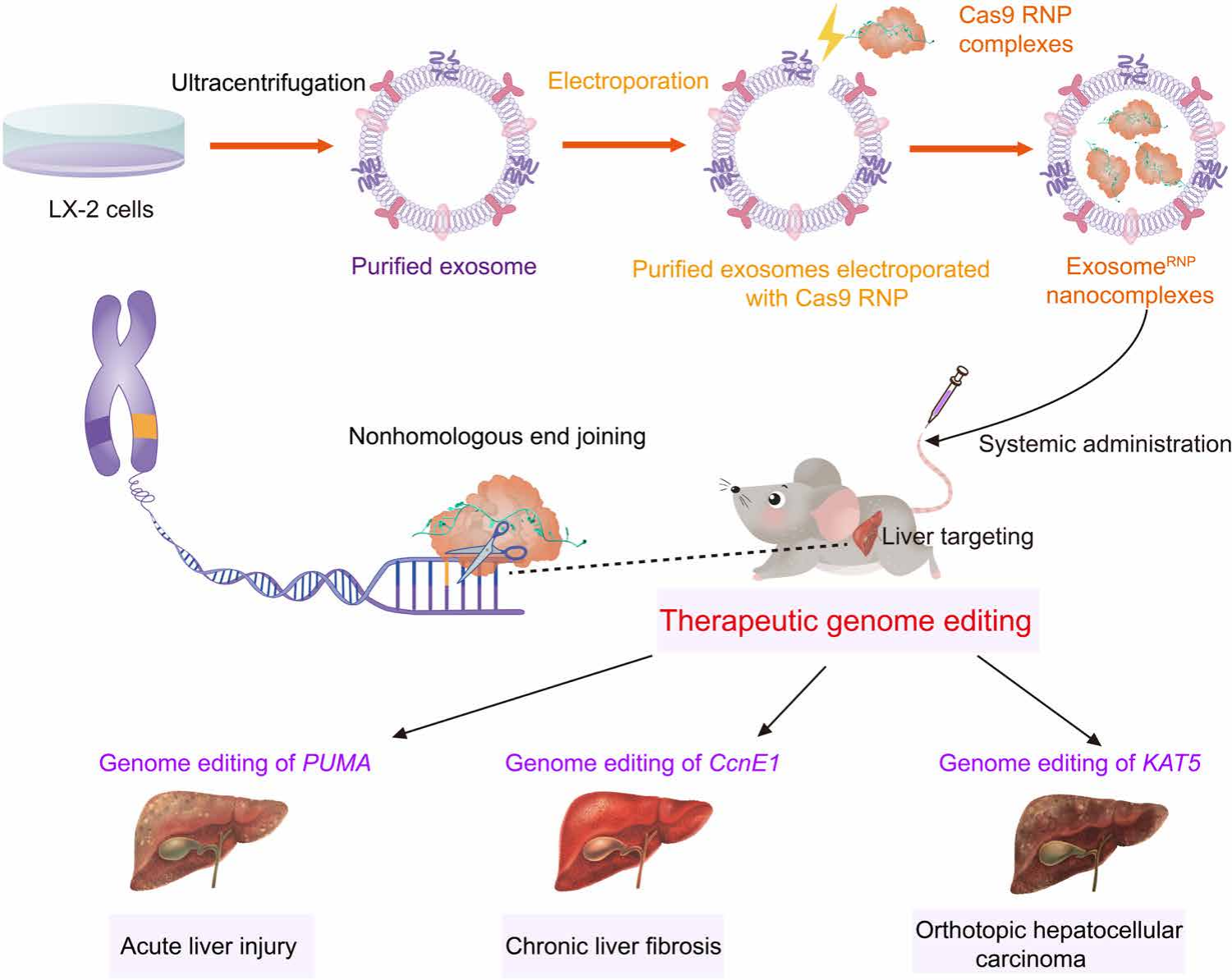
图1. 肝靶向Cas9蛋白外泌体的制备及其在肝疾病基因治疗中的应用(图片来源:Sci. Adv.)
多种肝脏疾病的基因治疗
疾病模型1:急性肝损伤,靶基因:p53上调的凋亡调节剂(PUMA)。在对乙酰氨基酚诱导的小鼠急性肝损伤模型中,间隔48 h的两次给药后,ExosomeRNP实现了小鼠肝部位PUMA基因约26.1%的敲除效率,并且显著抑制了对乙酰氨基酚导致的血清丙氨酸转氨酶(AST)和天冬氨酸转氨酶(ALT)水平的升高。苏木精-伊红(H&E)染色结果显示ExosomeRNP治疗组小鼠的肝部位小叶中心细胞坏死和充血状况得到显著缓解,TUNEL细胞凋亡检测表明ExosomeRNP显著降低了小鼠肝部位细胞凋亡的比例,进而提高了小鼠72 h的存活率。
疾病模型2:慢性肝纤维化,靶基因:细胞周期蛋白E1(CcnE1)。CcnE1蛋白是周期蛋白依赖性激酶家族的一员,它能够促进肝星状细胞的增殖,在肝纤维化形成过程中发挥着重要的作用,抑制CcnE1蛋白的表达能够抵抗肝脏的纤维化。在四氯化碳诱导的小鼠实质性肝纤维化模型中,每周两次共计八次给药后,ExosomeRNP实现了小鼠肝部位CcnE1基因约9.7%的敲除效率,并显著抑制了四氯化碳诱导的CcnE1蛋白及α-平滑肌肌动蛋白的高表达,阻止了肝纤维化的发生。天狼星红和马森染色(评价肝纤维化水平)结果显示,ExosomeRNP治疗组小鼠肝部位天狼星红和马森阳性区域显著小于其他对照组,表明ExosomeRNP能够有效抑制四氯化碳导致的慢性肝纤维化进程(图2)。
疾病模型3:原位肝癌,靶基因:赖氨酸乙酰转移酶5(KAT5)。赖氨酸乙酰转移酶5在肝癌的发生与进展中发挥着重要的作用,敲除编码赖氨酸乙酰转移酶5的基因能够抑制肿瘤的生长。在原位肝癌(Huh-7细胞)小鼠模型中,每周两次共计八次给药后,ExosomeRNP实现了小鼠原位肝肿瘤KAT5基因约21.3%的基因敲除效率,并降低了赖氨酸乙酰转移酶5的表达水平,抑制了肿瘤的生长,进而显著提高了小鼠的存活率,展现了ExosomeRNP在原位肝癌治疗中的极大潜力。
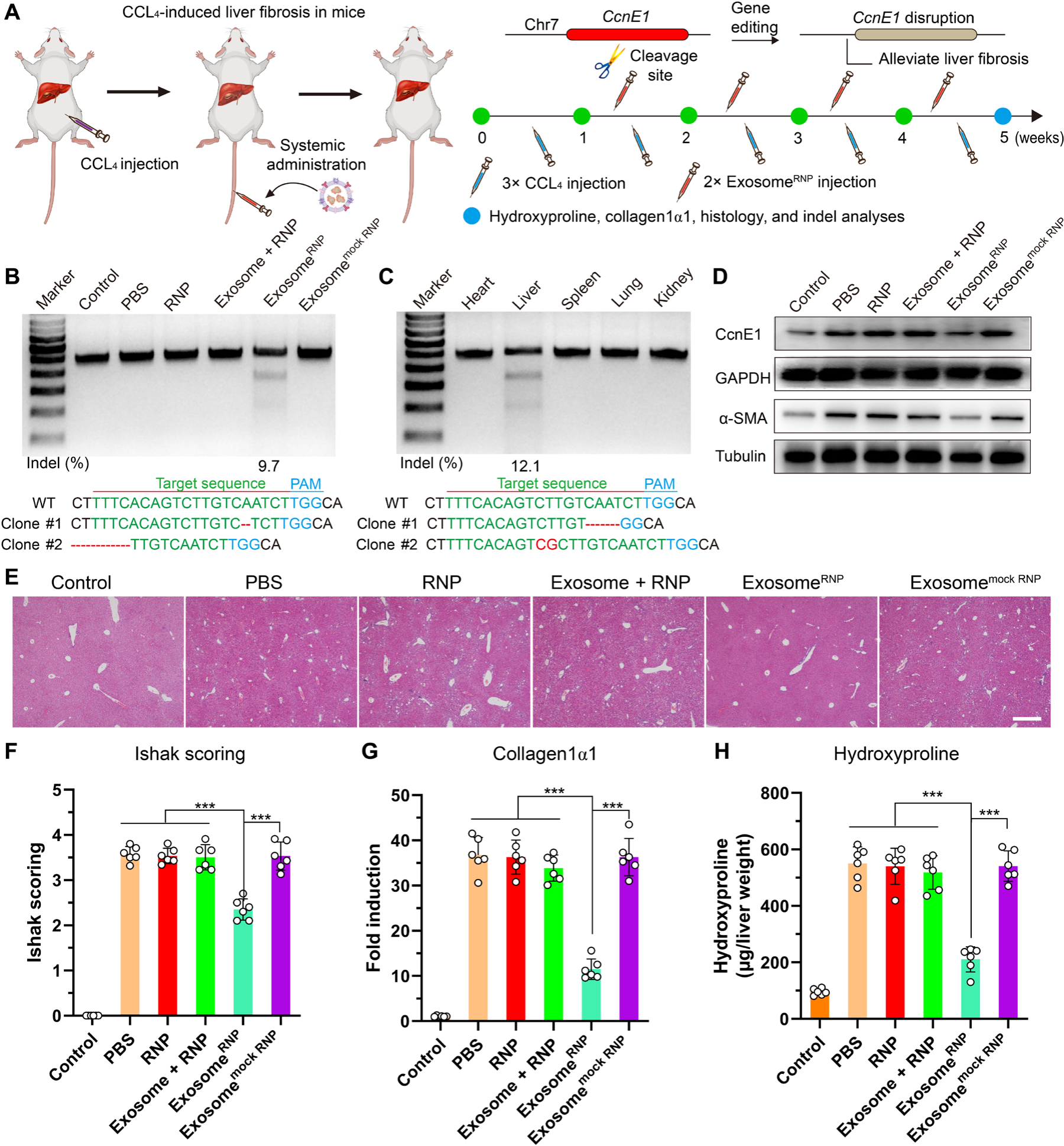
图2. ExosomeRNP介导的基因编辑抑制四氯化碳诱导的肝纤维化(图片来源:Sci. Adv.)
总结 本文中,作者通过差速及超高速离心法制备并纯化了来源于人肝星状细胞LX-2的外泌体,以电穿孔的方式将基因编辑蛋白Cas9/sgRNA RNP负载到外泌体内部,通过包裹靶向不同肝疾病基因的RNP制备得到一系列具有肝靶向的治疗性外泌体ExosomeRNP。在急性肝损伤、慢性肝纤维化、及原位肝癌小鼠模型中,ExosomeRNP能够特异性敲除肝脏部位相关疾病基因,抑制相关疾病的发生与发展,在肝疾病治疗中展现了极大的潜力。此外,该方法还能够用于负载其它蛋白质药物,是一个通用且高效的非病毒蛋白质载体。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn