

(图片来源:J. Am. Chem. Soc.)
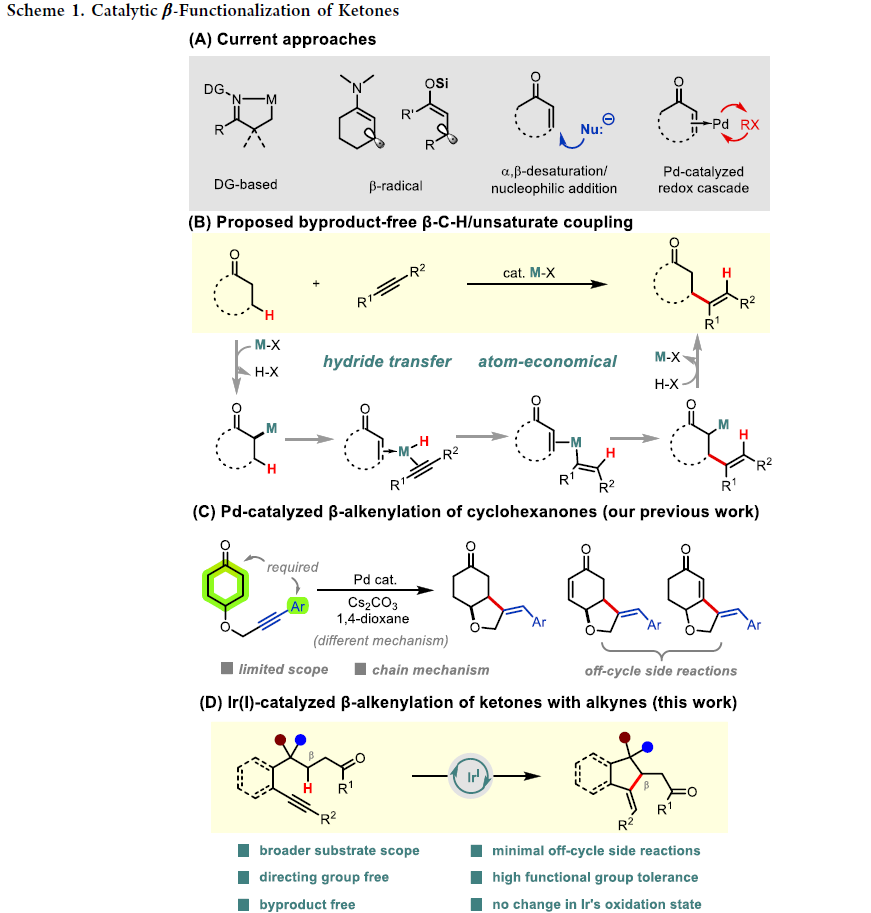
酮类结构普遍存在于化学原料和合成中间体中,它们是实现有机分子官能团化的重要转化基团。由于酮羰基及其α-位活性较高,因此若想在其相对惰性的β-位直接实现官能团化则具有一定的挑战性。传统的α,β-烯酮的共轭加成策略已经在复杂分子合成中得到了广泛的应用。近些年,基于导向C-H金属化或β-自由基的形成来位点选择性地实现酮β-C(sp3)-H的官能团化得到了发展,但是均有特定的要求(Scheme 1A)。
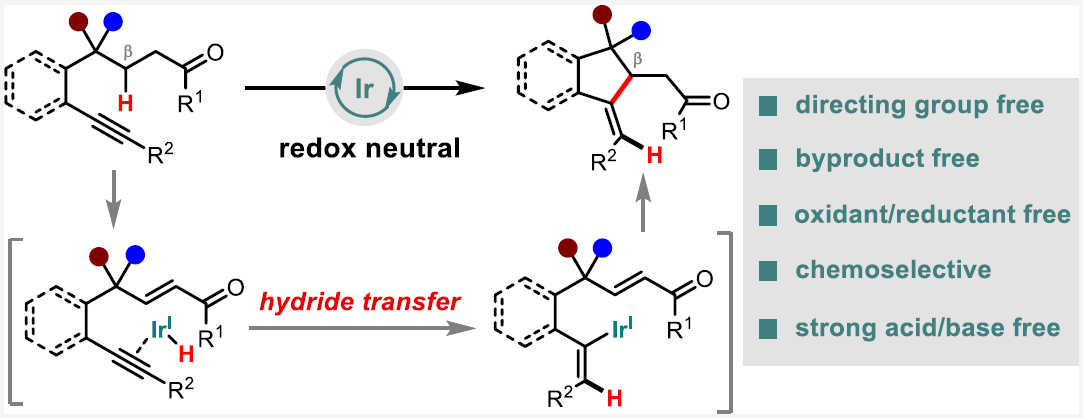
芝加哥大学董广彬课题组一直致力于开发钯催化的氧化还原串联策略利用有机卤化物来直接实现羰基化合物的β-芳基化、β-烷基化、β-烯基化反应。鉴于使用有机卤化物时会产生化学计量副产物,因此使用非活化烯烃或炔烃等不饱和烃作为β-官能团化试剂会更具有优势。如Scheme 1B所示,在经历了α-金属化和β-H消除后,金属-氢中间体可以通过迁移插入被不饱和烃捕获,从而生成新的碳-金属物种。此碳-金属物种随后经历与烯酮的共轭加成可以实现β-官能团化,并在质子化后再生催化剂。在此催化过程中,金属催化剂始终保持相同的氧化态,且不会有化学计量副产物生成。
为了实现这一目标,作者最近发展了钯催化环己酮与芳基炔烃的分子内β-烯基化反应(Scheme 1C)。然而,该反应的底物范围有限,且由于其具有多个副反应,因此反应效率较低。此外,详细的机理研究并不支持所提出的金属-氢化物途径,而是涉及环金属化和链转移过程。为了克服这些缺点,探索基于不同催化机理的新催化体系势在必行,且具有重要意义。最近,美国芝加哥大学董广彬课题组和武汉大学戚孝天课题组合作,发展了首例铱催化,利用内炔来直接实现酮的β-C-H烯基化反应。此反应在不需要导向基团以及氧化剂的存在下即可实现环酮和非环酮的β-烯基化,且机理研究表明反应经历了氢转移反应途径(Scheme 1D)。
(图片来源:J. Am. Chem. Soc.)
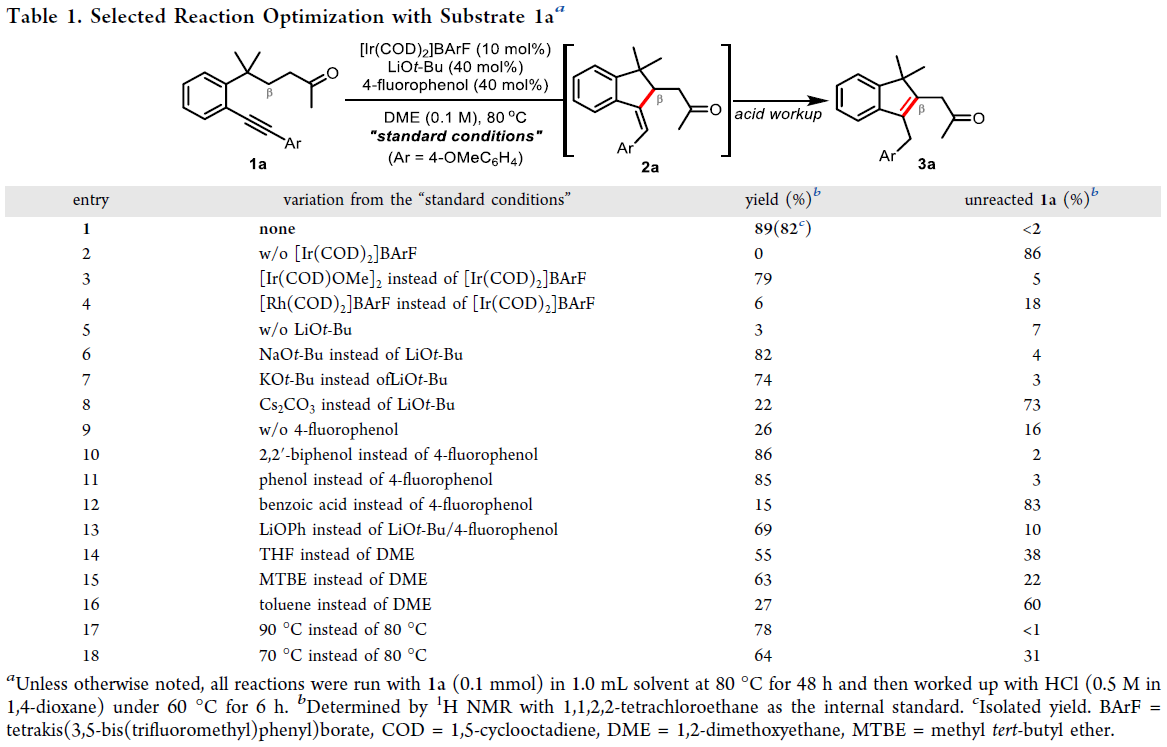
作者首先以炔烃连接的非环酮1a作为模板底物进行反应尝试以及条件筛选(Table 1)。当使用10 mol% [Ir(COD)2]BArF,40 mol% LiOt-Bu,40 mol% 4-氟苯酚,在DME(0.1 M)中,80oC下反应48小时。随后加入HCl(0.5 M in 1,4-dioxane)进行后处理后(60 oC搅拌6小时)可以以82%的分离产率得到目标β-烯基化产物3a(Table 1,entry 1)。
(图片来源:J. Am. Chem. Soc.)
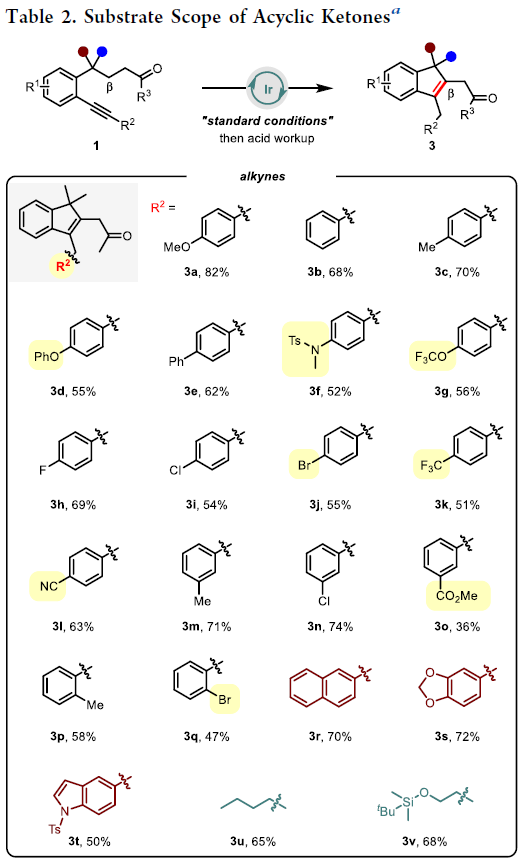
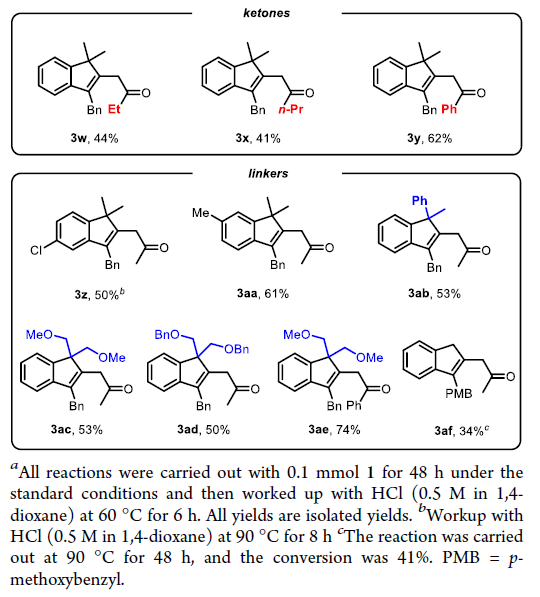
在得到了最优反应条件后,作者首先对非环酮1的底物范围进行探索(Table 2)。实验结果表明,连有不同电性芳基的炔烃部分均具有良好的兼容性,以36-82%的产率得到目标β-烯基化产物3a-3t。一系列不同的官能团,如苯基醚(3d)、磺酰胺(3f, 3t)、三氟甲基醚(3g)、卤素(3h, 3i, 3n, 3j, 3q)、三氟甲基(3k)、氰基(3l)、酯基(3o)、萘基(3r)、硅醚(3v)、杂环(3s, 3t)、烷基(3u, 3v)等均可良好兼容。除了甲基酮以外,其它烷基取代的酮(3w, 3x)以及苯基酮(3y)也均可以顺利实现转化。此外,苯环上的不同取代(3z, 3aa)以及羰基γ-碳上的不同偕二取代(3ab-3ae)均具有良好的兼容性。值得注意的是,当γ-碳上不存在偕二取代时,可能是缺少了Thorpe-Ingold效应,使得产物3af的产率相对较低(34%)。
(图片来源:J. Am. Chem. Soc.)
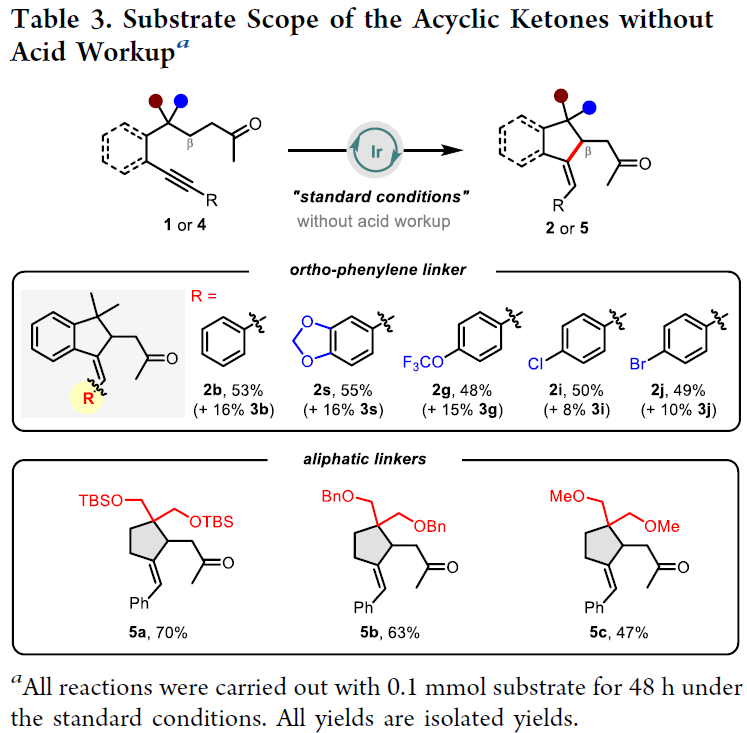
为了保留最初形成的环外烯烃部分,在不加入酸进行后处理的情况下,作者进行了进一步探索(Table 3)。在不经HCl后处理的情况下,确实可以分离出相应的γ,δ-烯酮2作为主要产物。进一步的研究表明,在没有苯基连接的情况下,β-烯基化反应仍可顺利进行,以47-70%的产率生成简单的环戊烷产物5a-5c。虽然Thorpe-Ingold效应对此类底物仍然非常重要,但该方法展示了获取更多样化产物的潜力。
(图片来源:J. Am. Chem. Soc.)
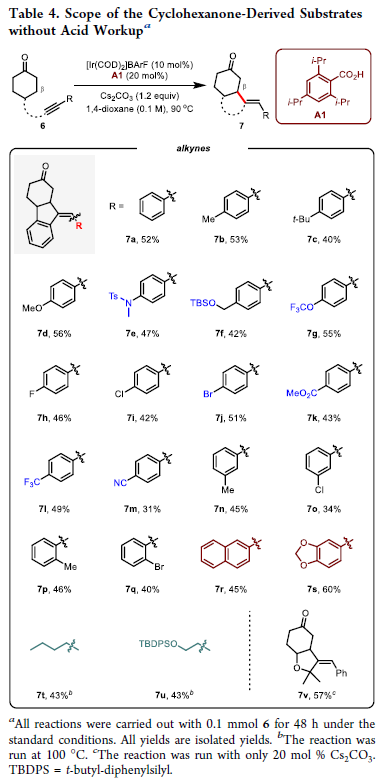
除了非环酮外,作者对环酮的兼容性进行了探索(Table 4)。在对一系列反应参数进行调控后,当使用20 mol% 2,4,6-三异丙基苯甲酸A1和1.2 equiv Cs2CO3 作为添加剂,1,4-二氧六环作溶剂时仍可以以31-60%的产率实现β-烯基化产物7的合成。值得注意的是,此类底物在之前发展的钯催化反应体系(J. Am. Chem. Soc. 2020, 142, 8962)中是不兼容的。
(图片来源:J. Am. Chem. Soc.)
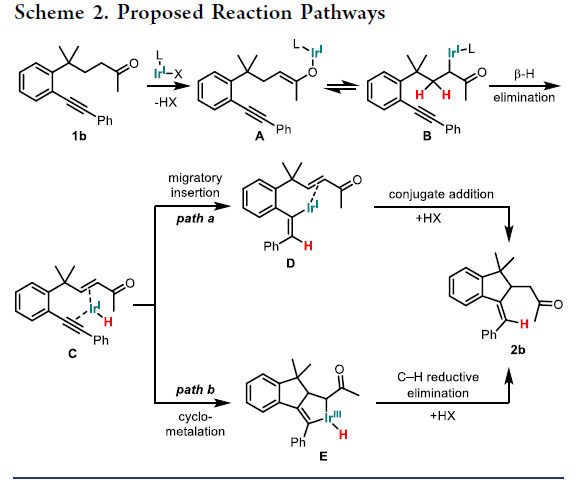
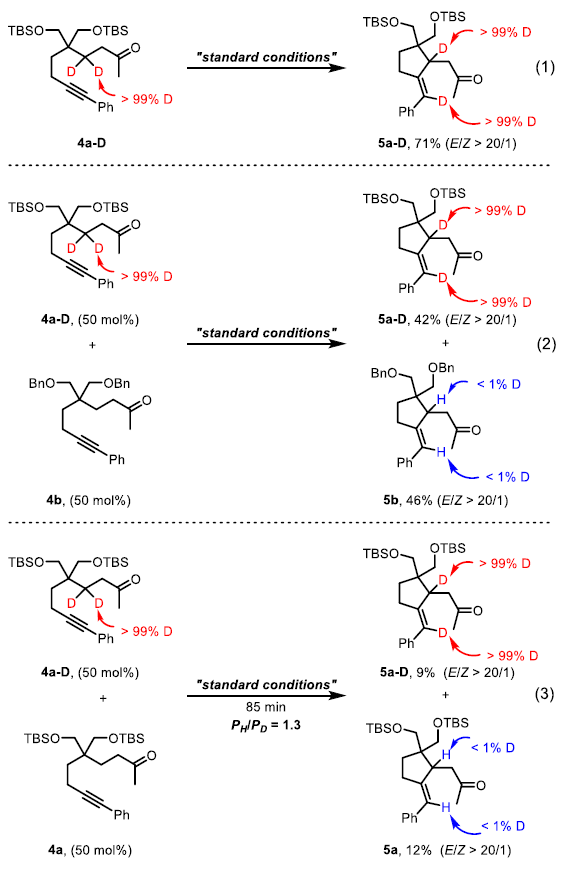
为了深入探索反应机理,作者进行了同位素标记实验。首先,β-氘代底物4a-D在标准条件下反应可以得到产物5a-D,且氘原子几乎完全转移到烯基上,由此表明烯基氢只来自酮的β-位(eq 1)。此外,β-氘代底物4a-D与非氘代底物4b的交叉实验表明分子间并没有发生氢迁移,由此说明β-氢的转移过程必须是分子内过程(eq 2)。这些实验结果与之前Pd催化的β-烯基化反应(其会涉及分子间的氢转移过程)形成鲜明对比。最后,KIE实验(KIE = 1.3)表明酮的β-位C-H键断裂或α-位C-H键断裂均不是此转化的决速步骤(eq 3)。基于上述实验结果,作者提出了此转化可能的反应机理(Scheme 2)。首先,1b通过碱协助的α-脱质子反应形成Ir(I)烯醇中间体(A/B)后经历快速的β-氢消除,从而形成了Ir(I)-H中间体C;在此阶段则会出现两种可能的路径。Path a表明Ir(I)-H经历了分子内炔的插入,其中氢被加到末端碳上(中间体D)。随后经历共轭加成和α-质子化形成β-C-C键,并随着Ir(I)的再生而得到目标产物2b。Path b表明通过烯炔的环金属化反应可生成Ir(III)金属环并构建β-C-C键(中间体E)。随后经历C-H还原消除和α-质子化反应得到目标产物2b。
(图片来源:J. Am. Chem. Soc.)
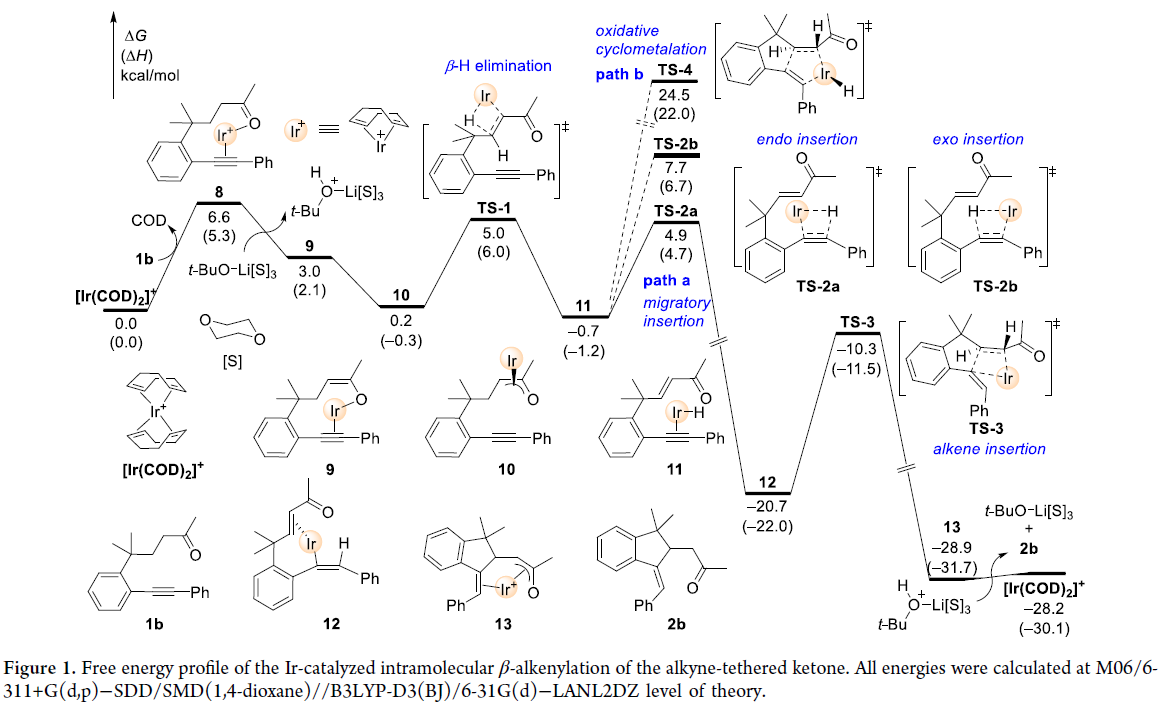
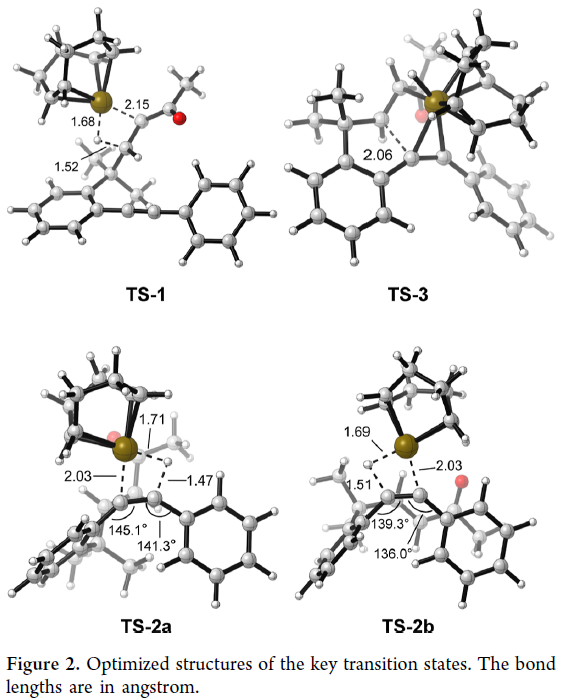
接下来,为了区分上述两种反应途径以及更深入地理解反应机理,作者以1b为模板底物进行了DFT计算(Figure 1)(Figure 2)。实验结果表明此Ir(I)催化的β-烯化反应最有利的反应途径应该是经历去质子化、β-H消除、炔的endo插入、烯烃插入以及α-质子化。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
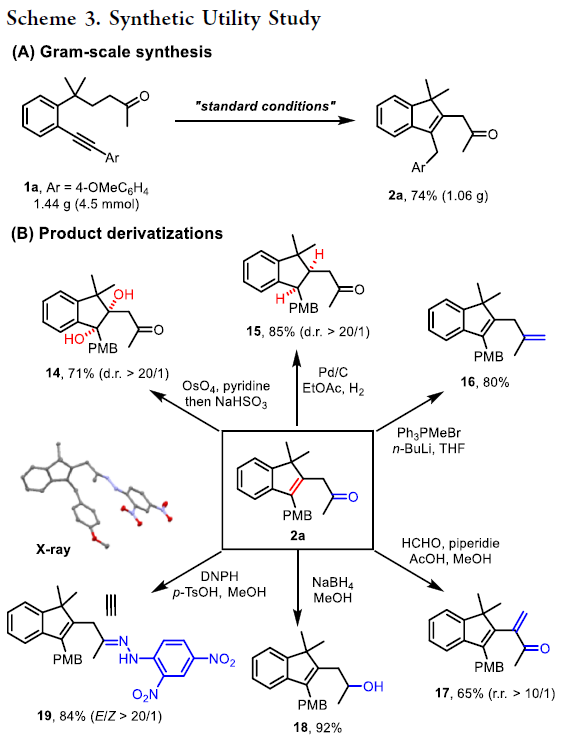
最后,作者进行了合成应用实验。首先,当此转化放大至克级规模合成时仍可以以74%的产率实现β-烯基化产物2a的合成(Scheme 3A)。随后,作者利用合成出的产物2a进行了多样合成转化,包括烯基的双羟化、酮的还原等,以良好的产率构建了多种衍生化产物14-19(Scheme 3B)。
(图片来源:J. Am. Chem. Soc.)
总结
美国芝加哥大学(University of Chicago)董广彬课题组和武汉大学戚孝天课题组合作,发展了首例铱催化,利用内炔来直接实现酮的β-C-H烯基化反应。该反应避免了导向基团的使用且具有良好的底物适用性和官能团兼容性。机理研究表明反应经历了高效的氢转移路径,包括α-去质子化、β-H消除、内炔插入、共轭加成、α-质子化等过程。此反应的发展为羰基的β-C-H官能团化过程提供了新的途径和新的思路。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn