

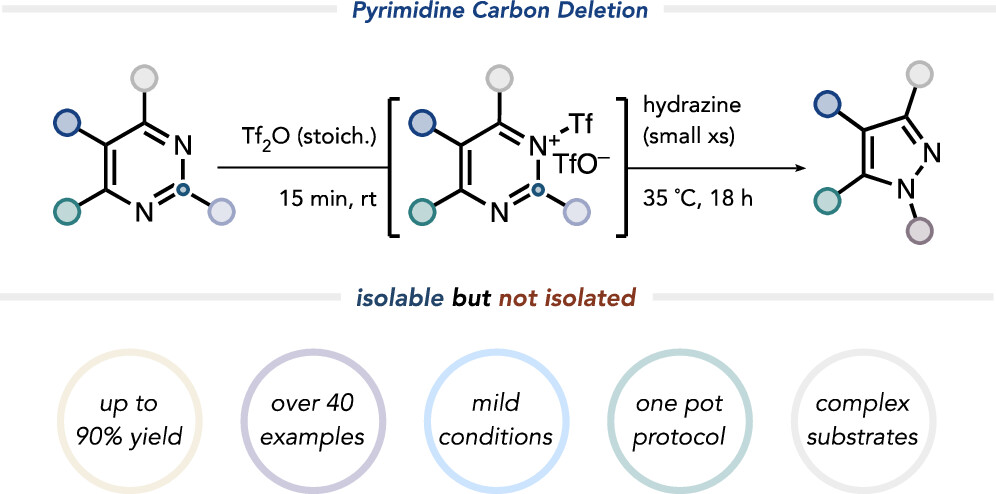
截止到2014年,在美国食品药品监督管理局批准的最畅销的200种药物分子结构中,含有至少一个氮杂原子的药物分子占到了总数的59%。而这其中,嘧啶是最常见的二嗪(数量占比排第六位),吡唑是最常见的二唑。由于它们特殊的结构性质,这些含氮杂环的引入对提高药物分子的活性和多样性通常是非常显著的,例如,它们可以与生物靶标形成诸如氢键的作用力来改善药物活性。此外,针对这些杂环的后期结构修饰也可以加快新型药物和农用化学品发现的步伐。而如果可以通过分子骨架编辑的手段直接对这类含氮杂环分子进行骨架重塑,则可以有效避免化学家们为了实现分子改造而不得不重新设计分子合成路线的麻烦。与之形成鲜明对比的是,药物分子骨架的直接编辑相对于外围的分子改造是非常困难的,并且这一领域也是近些年才兴起的(图1A),可参考借鉴的经验很少。
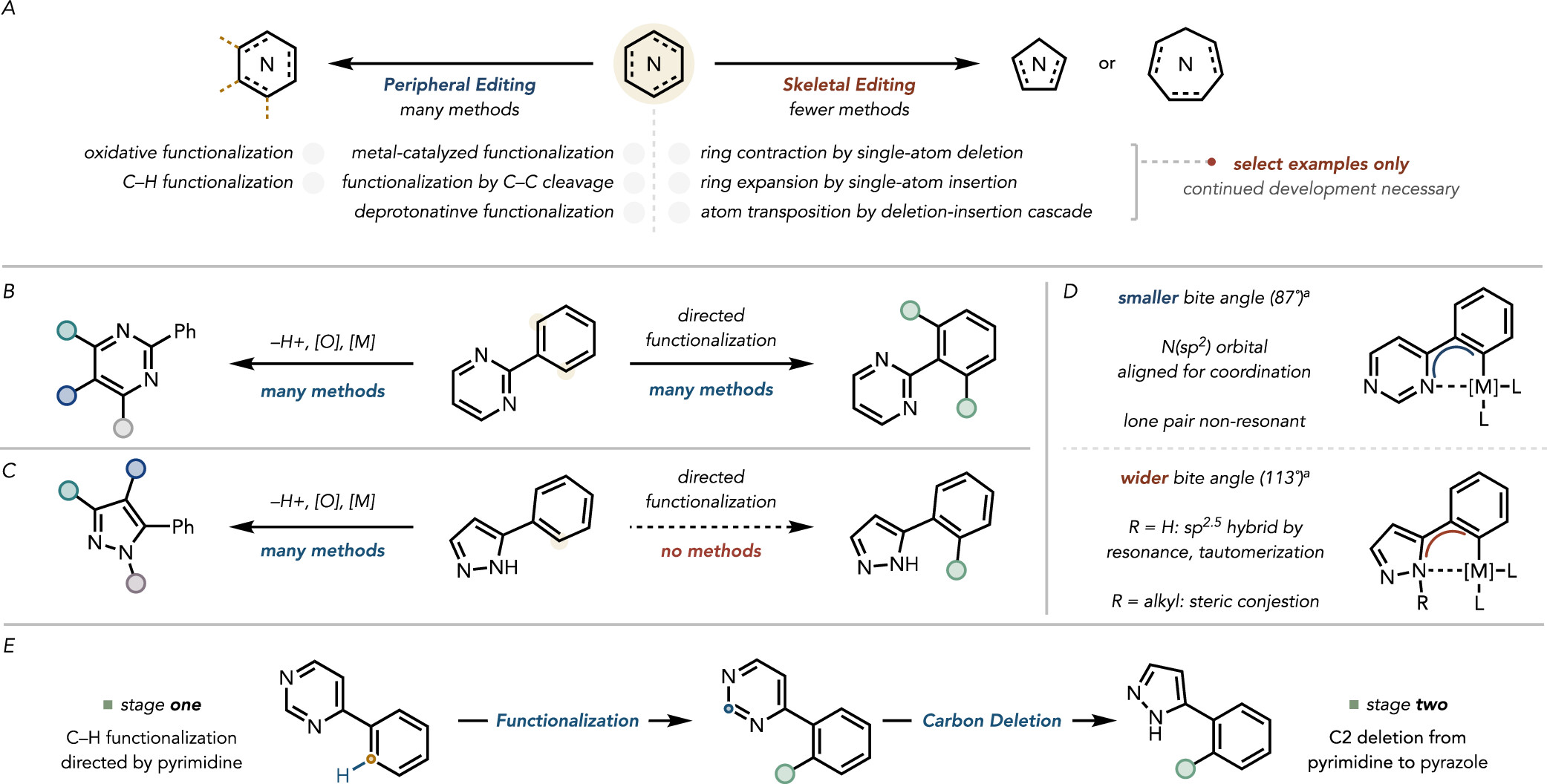
图1. 研究背景一 (图片来源: J. Am. Chem. Soc.)
嘧啶杂环在C-H键活化领域是一种非常良好的导向基团,相对而言,吡唑类杂环却是一种较差的导向基团,如果可以通过分子骨架编辑实现嘧啶变吡唑,则可以提供一种变相的吡唑导向的C-H键活化(图1C);除此之外,通过分子骨架编辑将其它杂环转化为嘧啶杂环已有报道,例如Morandi课题组报道了通过氮原子插入实现吲哚变喹唑啉(Science 2022, 377, 1104-1109),Levin课题组报道了碳卡宾插入吡唑N-N键生成2-芳基嘧啶(J. Am. Chem. Soc. 2022, 144, 19258-19264)。而通过分子骨架编辑合成吡唑却鲜有报道。事实上,早在1968年,Van der Plas和Jongejan就发现在溶剂量的水合肼存在下将嘧啶加热至200 °C可将其转化成吡唑(图2A)。然而在该条件下含有取代基的嘧啶却无法转化成吡唑。后来化学家们发现通过嘧啶N-甲基化降低嘧啶环的LUMO能量,从而提高水合肼的亲核进攻能力,进而可实现在100 °C下将嘧啶变吡唑(图2A)。尽管这种两步反应策略可以将反应条件变的非常温和,但是底物范围仍然非常有限,并且需要用到溶剂量的碘甲烷。
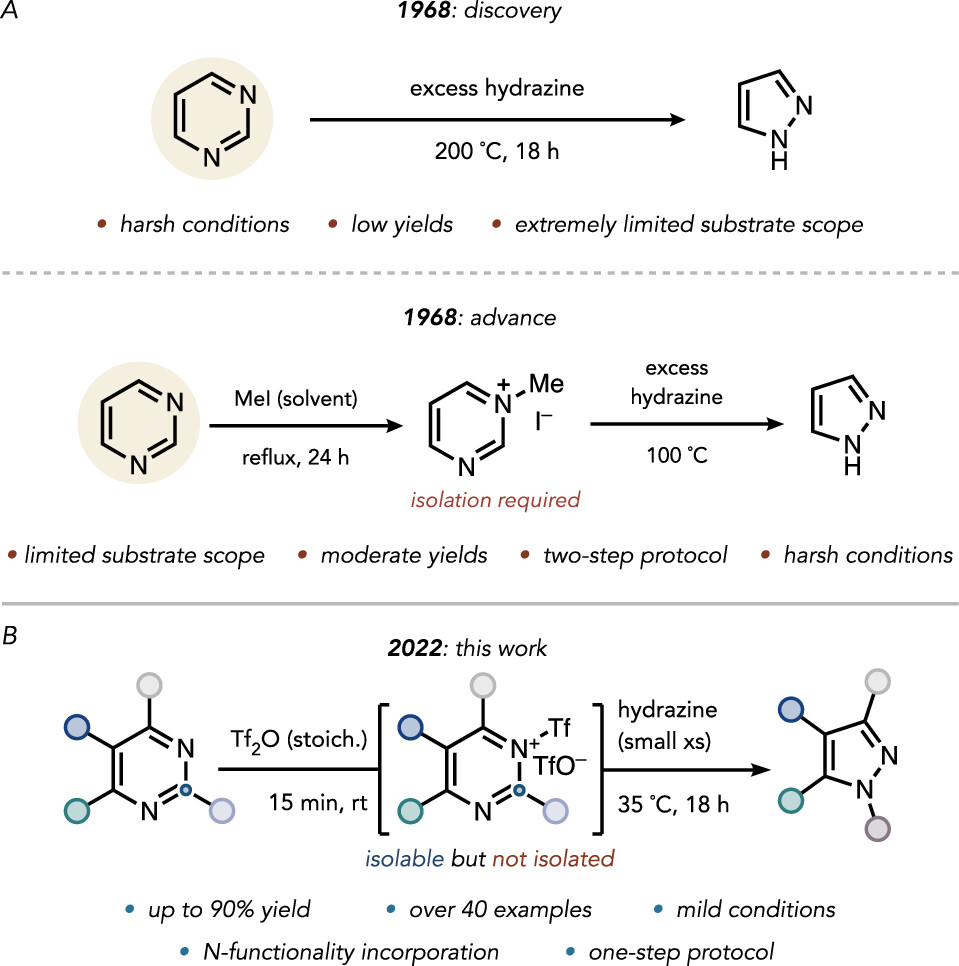
图2. 研究背景二 (图片来源: J. Am. Chem. Soc.)
考虑到该反应的使用价值及前人的研究经验,作者设想能否找到一种方法可以进一步降低嘧啶杂环的LUMO能量,从而在更温和的条件下实现嘧啶变吡唑,同时又能实现更广的底物范围。作者首先借助于计算机辅助策略来分析该设想的可行性(图3)。他们发现,嘧啶N-三氟甲磺酰化可以更高效地降低嘧啶LUMO能量,从而可以实现室温条件下肼的亲核进攻。基于这种预测,他们随后通过大量的优化实验,最终证实了三氟甲磺酸酐是一种非常有效的嘧啶活化剂(图4),可以实现室温条件下一锅法嘧啶变吡唑。这种通过形式上的碳剔除方法可以将二嗪类杂环转化为FDA批准的药物中最常见的二唑。
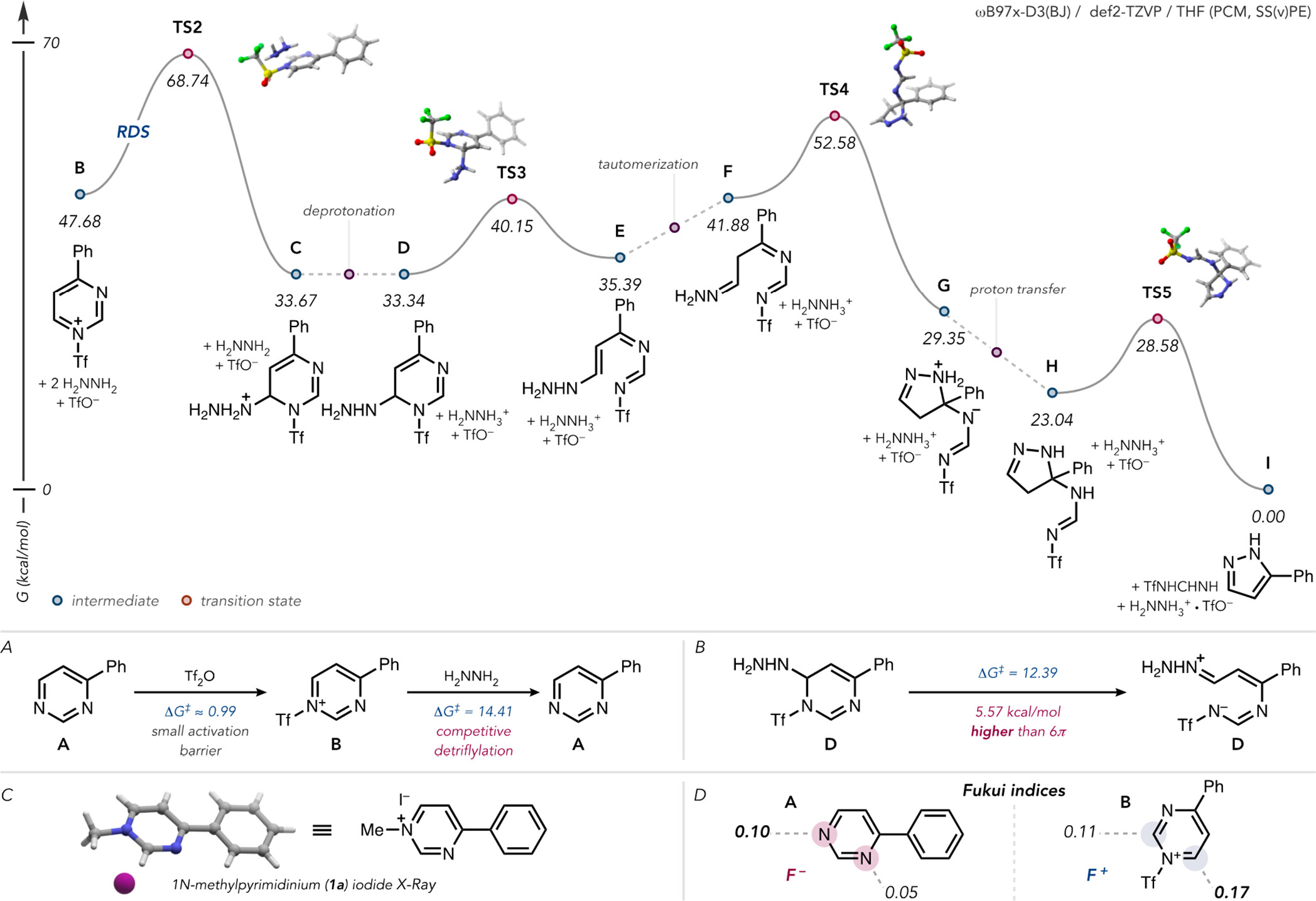
图3. 反应机理研究 (图片来源: J. Am. Chem. Soc.)
本文中,作者首先详细的分析了该反应可能的机理。首先,在选择性上,空间位阻最小的嘧啶氮原子更容易进行三氟甲磺酰化(ΔG⧧ ≈ 0.99 kcal/mol;图3A)。这一选择性也进一步通过4-苯基嘧啶的甲基化实验(1a,图 3C)和通过计算得到的Fukui亲核指数(图3D)予以证实。随后亲核性的肼进攻活化嘧啶的C-6位得到中间体C。DFT计算发现此步为限速步(图3)。同时,作者发现在此阶段,较低温度下脱三氟甲磺酰基是非常显著的副反应,会严重降低反应的收率(图 3A)。具有较高酸性的中间体C去质子化得到中间体D,随后开环得到中间体E。通过互变异构之后得到的中间体F的末端氮原子与C-4反应关环形成中间体G。随后通过质子转移和1,5-sigmatropic氢迁移消除三氟甲基甲脒基团,生成最终的吡唑产物。
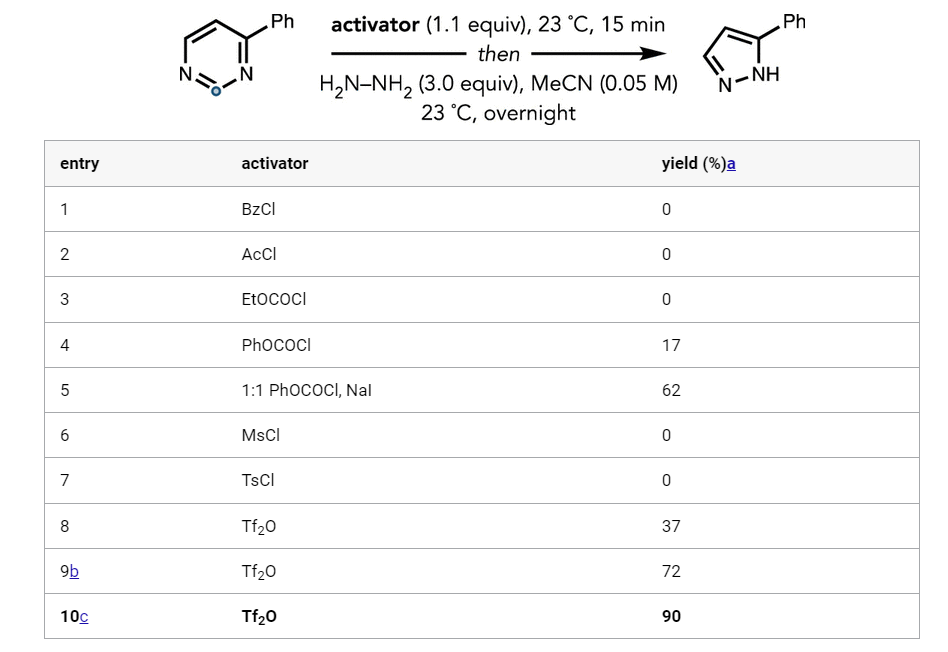
图4. 反应条件优化 (图片来源: J. Am. Chem. Soc.)
得到最佳反应条件后,作者探索了该反应的底物适用性。如图5A所示,对比2a和2b的收率可以发现,该反应可以兼容不同电性的苯环。芳环邻位和间位取代的衍生物具有相似的反应活性(3a和3b, 4a和4b)。同时,该反应也可以非常好的兼容卤素取代基(5和6)。需要特别指出的是,嘧啶环上也可以良好的兼容各类杂环(产物7-10)。随后作者进一步探究了嘧啶环本体的官能团兼容性(图5B)。作者发现该反应可以很好的兼容各类取代基,如给电子基团(19)、苯环(22)、卤素(24和25)和氰基(26)等。需要指出的是,吸电子取代基的存在往往会降低反应效率(24-27)。最后,作者尝试合成了一系列N-1位有取代的吡唑类衍生物(图5C)。通过对比可以发现,相对于没有取代的肼,苯基取代肼反应活性往往会降低很多,这可能是由于取代基的存在降低了肼的亲核活性。
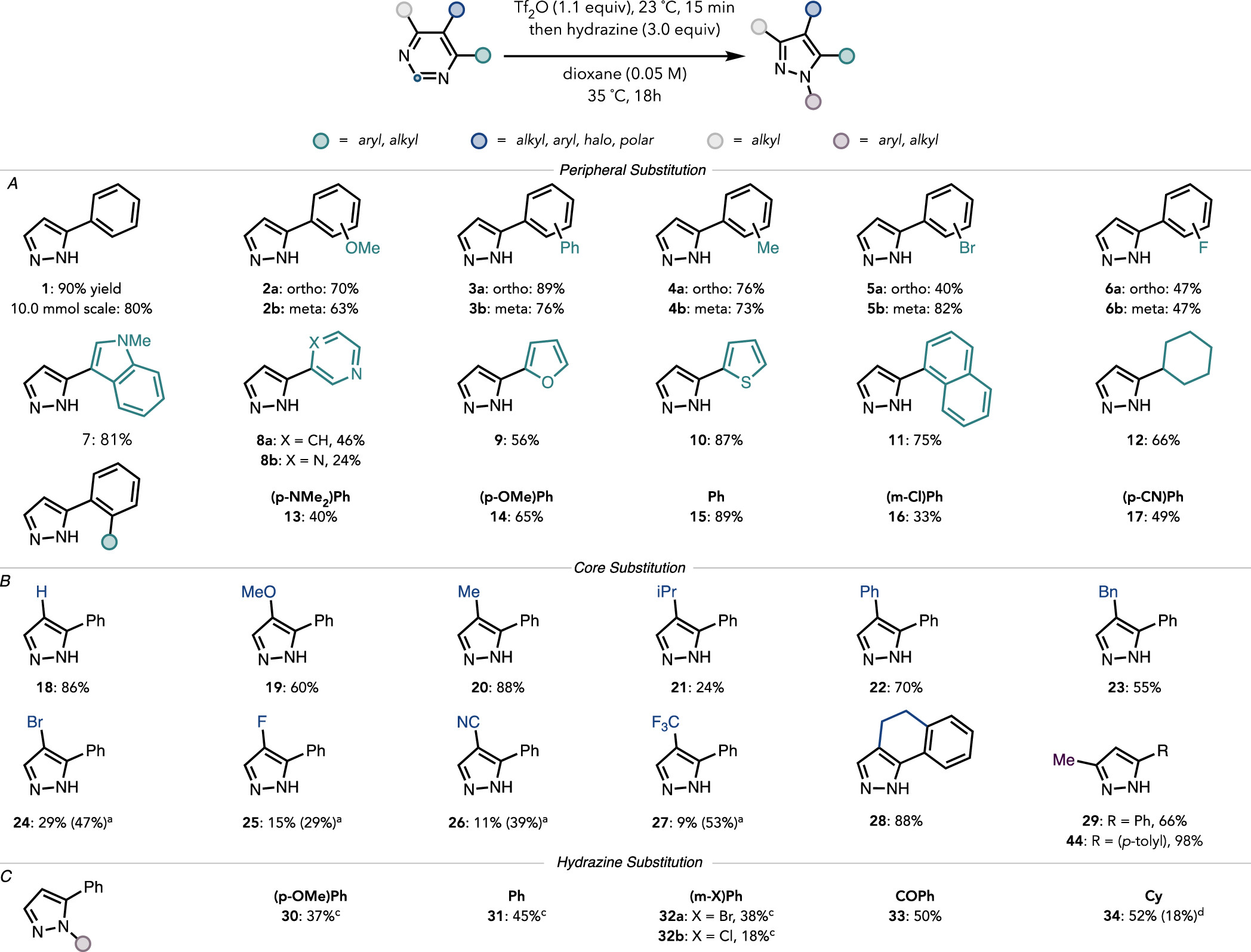
图5. 底物范围 (图片来源: J. Am. Chem. Soc.)
与此同时,作者发现,对反应条件稍加优化,该反应也可以兼容游离的羟基和氨基(图6A)。为了证明该反应的实用性,作者直接对结构相对复杂的药物分子进行骨架编辑(图6C):含有嘧啶环的药物衍生物如benzpyrimoxan,Fenarimol,Rivaroxaban等都可以以良好的收率转变为含吡唑类的结构。最后,作者通过连续的嘧啶导向的C-H键活化和嘧啶分子骨架编辑,顺利合成Celecoxib衍生物(图6D)。具体而言,采用4-苯基嘧啶类底物44为起始原料,利用嘧啶环的导向能力,以定量收率实现金属钌催化的C-H键双芳基化(45,100% 收率),进而采用本文报道的条件,实现碳原子剔除,嘧啶变吡唑,以53%的收率合成了Celecoxib衍生物(46)。
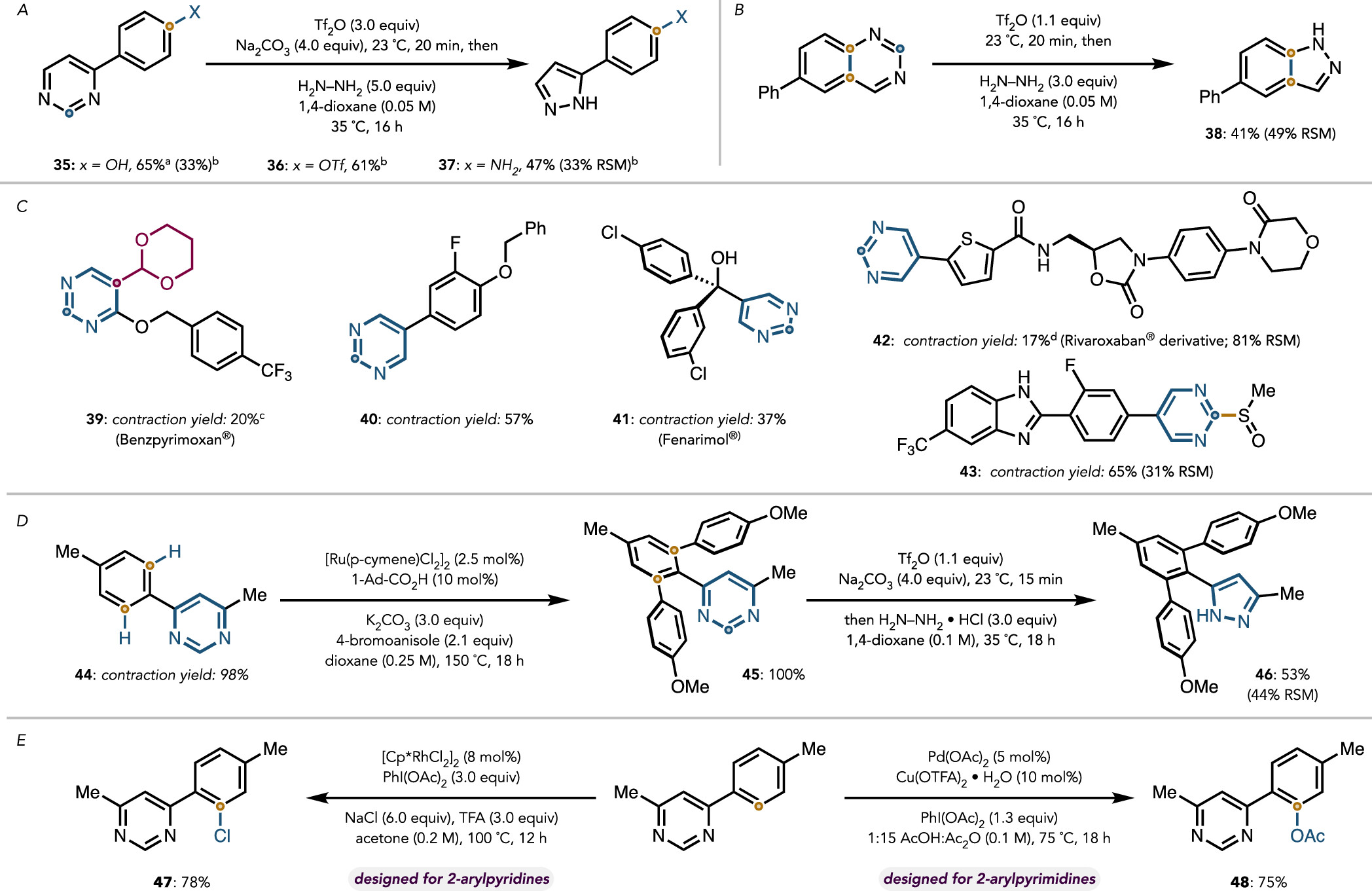
图6. 合成应用 (图片来源: J. Am. Chem. Soc.)
总结
加州大学伯克利分校Sarpong教授课题组报道了通过形式上的碳原子剔除实现嘧啶变吡唑。该反应是Sarpong教授在分子骨架编辑领域的又一力作,展示了“单原子”骨架编辑的概念。该反应条件温和,底物范围广泛,可以被很好的应用于复杂药物分子的直接编辑。该方法还提供了获得各种N2取代吡唑的途径,而这些取代的二唑在C-H键官能团化中的定向能力差且通过取代的区域选择性官能团化制备它们极其困难。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn